题目内容
Fe3+在工业上有重要用途.印刷电路板是由铜箔复合而成,可用FeCl3溶液作腐蚀剂刻制,生成CuCl2和FeCl2.请把反应式配平:Cu+FeCl3═CuCl2+FeCl2,改写为离子方程式:______.并比较氧化性:FeCl3______CuCl2.
Cu+FeCl3═CuCl2+FeCl2中,
Cu元素由0升高到+2价,
Fe元素由+3价降低为+2价,
由电子守恒可知,Cu与FeCl3的化学计量数之比为1:2,
配平的化学反应为Cu+2FeCl3═2CuCl2+FeCl2,
离子反应为Cu+2Fe3+═2Cu2++Fe2+,
由氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,
则氧化性为FeCl3>CuCl2,
故答案为:Cu+2Fe3+═2Cu2++Fe2+;>.
Cu元素由0升高到+2价,
Fe元素由+3价降低为+2价,
由电子守恒可知,Cu与FeCl3的化学计量数之比为1:2,
配平的化学反应为Cu+2FeCl3═2CuCl2+FeCl2,
离子反应为Cu+2Fe3+═2Cu2++Fe2+,
由氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,
则氧化性为FeCl3>CuCl2,
故答案为:Cu+2Fe3+═2Cu2++Fe2+;>.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目


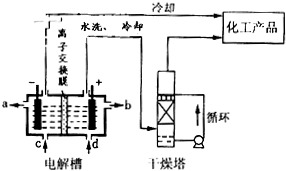
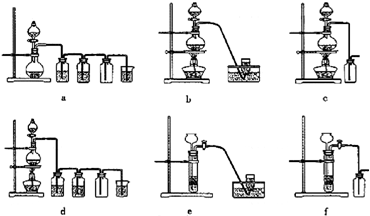
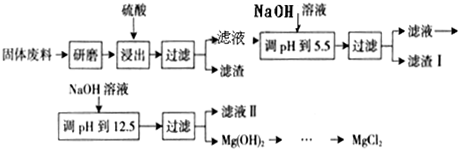
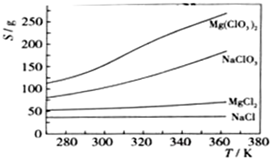

 4Fe(OH)3+8OH-+3O2.在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
4Fe(OH)3+8OH-+3O2.在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用