题目内容
(2008?石家庄模拟)A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,A是地壳中含量最高的元素,B、C、D同周期,E和其他元素既不在同一周期也不在同一主族,D的氢化物和最高价氧化物对应的水化物均为强酸,且B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.据此回答下列问题:
(1)A和D氢化物中,沸点较低的是
(2)元素C在元素周期表中的位置是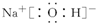
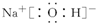 .
.
(3)A、D、E可以形成多种盐,其中一种盐中A、D、E三种元素的原子个数比为2:2:1,该盐的名称为
(1)A和D氢化物中,沸点较低的是
D
D
(选填“A”或“D”).(2)元素C在元素周期表中的位置是
第三周期ⅢA族
第三周期ⅢA族
,B的最高价氧化物对应水化物的电子式为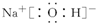
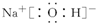
(3)A、D、E可以形成多种盐,其中一种盐中A、D、E三种元素的原子个数比为2:2:1,该盐的名称为
次氯酸钙
次氯酸钙
,它的水溶液与D的氢化物的水溶液反应可生成D的单质,该反应的离子方程式为ClO-+2H++Cl-═Cl2↑+H2O
ClO-+2H++Cl-═Cl2↑+H2O
.分析:A是地壳中含量最高的元素,应为O元素,D的氢化物和最高价氧化物对应的水化物均为强酸,应为Cl元素,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水,则C为
Al元素,B为Na元素,E的原子数序最大,E和其他元素既不在同一周期也不在同一主族,应为Ca元素,根据对应原子结构特点以及对应单质、化合物的性质解答该题.
Al元素,B为Na元素,E的原子数序最大,E和其他元素既不在同一周期也不在同一主族,应为Ca元素,根据对应原子结构特点以及对应单质、化合物的性质解答该题.
解答:解:根据题设条件可推知A为O,B为Na,C为Al,D为Cl,E为Ca,则
(1)由于H2O分子间存在氢键,其沸点高于HCl,故答案为:D;
(2)Al的原子核外有3个电子层,最外层电子数为3,则位于第三周期ⅢA族,Na的最高价氧化物对应的水化物为NaOH,Na+与OH-以离子键结合,OH-中,O原子与H原子以共价键结合,电子式为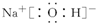 ,
,
故答案为:第三周期ⅢA族;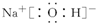 ;
;
(3)钙、氯、氧可形成Ca(ClO)2、Ca(ClO3)2、Ca(ClO4)2,其中满足题设条件下的盐为Ca(ClO)2(次氯酸钙),由于在酸性环境中ClO-具有强氧化性,Cl-具有还原性,二者发生氧化还原反应生成Cl2和H2O,离子反应为ClO-+Cl-+2H+═Cl2↑+H2O,
故答案为:次氯酸钙;ClO-+2H++Cl-═Cl2↑+H2O.
(1)由于H2O分子间存在氢键,其沸点高于HCl,故答案为:D;
(2)Al的原子核外有3个电子层,最外层电子数为3,则位于第三周期ⅢA族,Na的最高价氧化物对应的水化物为NaOH,Na+与OH-以离子键结合,OH-中,O原子与H原子以共价键结合,电子式为
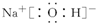 ,
,故答案为:第三周期ⅢA族;
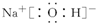 ;
;(3)钙、氯、氧可形成Ca(ClO)2、Ca(ClO3)2、Ca(ClO4)2,其中满足题设条件下的盐为Ca(ClO)2(次氯酸钙),由于在酸性环境中ClO-具有强氧化性,Cl-具有还原性,二者发生氧化还原反应生成Cl2和H2O,离子反应为ClO-+Cl-+2H+═Cl2↑+H2O,
故答案为:次氯酸钙;ClO-+2H++Cl-═Cl2↑+H2O.
点评:本题考查元素的推断,题目难度中等,注意氧化铝、氢氧化铝的两性,此为解答该题的关键,学习中注意积累元素化合物的知识.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
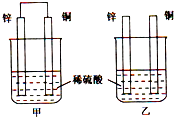 (2008?石家庄模拟)将纯锌片和纯铜片按下图所示方式插入同深度的稀硫酸中一段时间,以下叙述正确的是( )
(2008?石家庄模拟)将纯锌片和纯铜片按下图所示方式插入同深度的稀硫酸中一段时间,以下叙述正确的是( )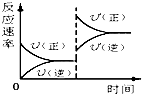 (2008?石家庄模拟)对于达到平衡的可逆反应:X+Y?W+Z,其他条件不变时,增大压强,正、逆反应速率(υ)变化的情况如图所示.下列对X、Y、W、Z四种物质状态的描述正确的是( )
(2008?石家庄模拟)对于达到平衡的可逆反应:X+Y?W+Z,其他条件不变时,增大压强,正、逆反应速率(υ)变化的情况如图所示.下列对X、Y、W、Z四种物质状态的描述正确的是( )