题目内容
【题目】下列叙述不正确的是( )

A.化学平衡发生移动,平衡常数不一定发生变化
B.升高温度会增大化学反应速率,原因是增加了活化分子的百分数
C.某化学反应的能量变化如上图所示,则该反应的△H>0,△S>0
D.H3PO4的电离常数:K1>>K2>>K3
【答案】C
【解析】
A. 浓度、压强改变,平衡移动,平衡常数不发生变化;温度改变,平衡移动,平衡常数一定发生变化,所以化学平衡发生移动,平衡常数不一定发生变化,故A正确;
B. 升高温度会增大化学反应速率,其原困增加了活化分子的百分数,故B正确;
C. 反应物的总能量大于生成物的总能量,反应放热,△H<0,无法物质的状态和化学计量数,不能判断熵变,故C错误;
D. 由于电离生成氢离子,抑制第二步电离、第三步电离,则H3PO4的电离常数:Kl>>K2>>K3,故D正确;
故选:C。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
i.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
ii.CO(g)+2H2(g)![]() CH3OH(g) △H2
CH3OH(g) △H2
iii.CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
(1)已知反应ii中的相关的化学键键能(“C![]() O”表示CO的化学键)数据见表:由此计算△H2=___kJ·mol-1。
O”表示CO的化学键)数据见表:由此计算△H2=___kJ·mol-1。
(2)反应i、ii、iii对应的平衡常数K1、K2、K3之间的关系式为___。
(3)一定条件下,在2L的恒容密闭容器中充入1molCO2和2molH2发生反应i。图1是反应体系中CO2的平衡转化率与温度的关系曲线。

①当温度为500K时,该反应10min达到平衡。0~10min时间内用CH3OH表示该反应的化学反应速率为___。
②若改充入1molCO2和3mol H2,则图1中的曲线会___(填“上移”或“下移”)。
(4)某温度下在容积为2L的密闭容器中充入1molCO和2molH2合成甲醇,发生反应ii,各组分物质的量随时间的变化情况如图2所示。
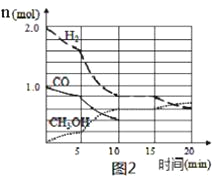
①5min至10min时速率变化的原因可能是___;
②若该反应在恒温恒压下进行,能说明该反应达到平衡状态的是___;
A.单位时间内消耗CO的浓度与生成CH3OH的浓度相等
B.混合气体的密度不变
C.CO和H2的体积分数之比不变
D.混合气体的平均相对分子质量不变
③15min时,增加反应体系中CO的物质的量(其他条件不变),至20min时反应重新达到平衡;则新加入的CO的物质的量为___mol(保留两位有效数字)。