题目内容
(12分) 在实验室,可以用如图所示的装置制取乙酸乙酯。回答下列问题:

(1)右侧试管中的盛放的是 ,导气管的下端不能插入液面以下,其目的是 。
(2)写出实验室制取乙酸乙酯的化学反应方程式 ,该反应的类型是 。
(3)该反应是典型的可逆反应,若不把生成的乙酸乙酯及时蒸馏出来,反应一段时间后,就会达到化学平衡状态。下列能说明该反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水;
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸;
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸;
④正反应的速率与逆反应的速率相等;
⑤混合物中各物质的浓度不再变化。

(1)右侧试管中的盛放的是 ,导气管的下端不能插入液面以下,其目的是 。
(2)写出实验室制取乙酸乙酯的化学反应方程式 ,该反应的类型是 。
(3)该反应是典型的可逆反应,若不把生成的乙酸乙酯及时蒸馏出来,反应一段时间后,就会达到化学平衡状态。下列能说明该反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水;
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸;
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸;
④正反应的速率与逆反应的速率相等;
⑤混合物中各物质的浓度不再变化。
(共12分)(1)饱和碳酸钠溶液 防止倒吸 (4分)
(2)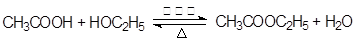 (3分)
(3分)
酯化反应(或取代反应)(2分) (3)②④⑤(3分)
(2)
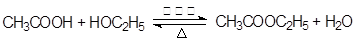 (3分)
(3分)酯化反应(或取代反应)(2分) (3)②④⑤(3分)
(1)由于乙酸和乙醇都是易挥发的,所以为了除去乙酸乙酯中的乙酸和乙醇,需要加入饱和碳酸钠溶液。由于乙酸和乙醇都是和水互溶的,所以为了防止倒吸,导管口不能插入液面以下。
(2)酯化反应也是取代反应,方程式为
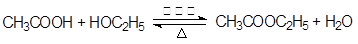 。
。
(3)在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。所以④⑤正确。①③中反应速率的方向是相同的,所以不能说明。②反应速率的方向相反,且满足速率之比是相应的化学计量数之比,可以说明,所以答案选②④⑤,
(2)酯化反应也是取代反应,方程式为
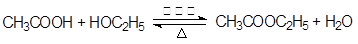 。
。(3)在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。所以④⑤正确。①③中反应速率的方向是相同的,所以不能说明。②反应速率的方向相反,且满足速率之比是相应的化学计量数之比,可以说明,所以答案选②④⑤,

练习册系列答案
相关题目
 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
 I2 + I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大
I2 + I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 CO2(g)+H2(g),反应物CO的物质的量在不同温度时物质的量随时间的变化如下表所示,回答下列问题:
CO2(g)+H2(g),反应物CO的物质的量在不同温度时物质的量随时间的变化如下表所示,回答下列问题:
 2SO3,状态Ⅱ时达平衡,则O2的转化率为( )
2SO3,状态Ⅱ时达平衡,则O2的转化率为( )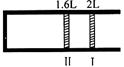
 2SO3这是一个正反应放热的可逆反应。下列有关说法中错误的是( )
2SO3这是一个正反应放热的可逆反应。下列有关说法中错误的是( ) 2C(气)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:①用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1
2C(气)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:①用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1