题目内容
(8分)Ⅰ 现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题:
⑴写出发生反应的离子方程式________________________________;
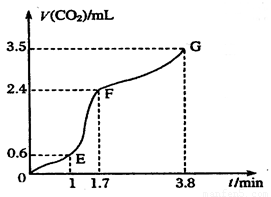
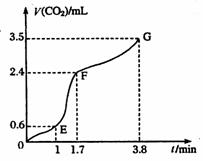
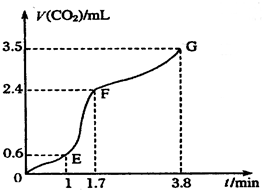
⑵实验过程中绘制出生成CO2的体积[V(CO2)]与时间(t)的关系如图所示,试分析判断OE段、EF段、FG段反应速率(分别用 (OE)、
(OE)、![]() (EF)、
(EF)、![]() (FG)表示)哪个最快______________;
(FG)表示)哪个最快______________;
比较OE段和EF段,说明EF段速率变化的主要原因可能是______________ ____
Ⅱ 反应A + 3B = 2C + 2D。在四种不同的情况下的反应速率分别为:
①υ(A)=0.15mol/(L·s) ②υ(B)=0.6mol/(L·s)
③υ(C)=0.4mol/(L·s) ④υ(D)=0.45mol/(L·s)
该反应进行的快慢顺序为__ 。
(8分)
Ⅰ⑴CaCO3+2H+=Ca2++H2O+CO2↑;⑵![]() (EF);温度较高、浓度较大
(EF);温度较高、浓度较大
Ⅱ ④>②=③>①
解析:I:反应速率是指单位时间内物质的量的改变值,在图像是当然是斜率大的地方速率大;速率主要决定于反应物的本性,但也受外界如温度、浓度等的影响。本反应开始后EF段的速率却最大,说明反应物浓度较大,但最主要的还是反应放出的热量所致。
II:把四个速率以方程式系数比为标准转化为同一物质的速率再进行比较。

 阅读快车系列答案
阅读快车系列答案I. 实验室里用二氧化锰和浓盐酸加热制取氯气,该反应的离子方程式为: MnO2+4H++2Cl—![]() Mn2++Cl2↑+2H2O,也可以利用反应:
Mn2++Cl2↑+2H2O,也可以利用反应:
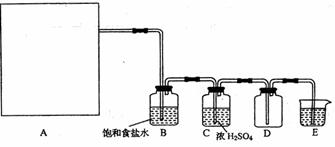
2KMnO4+16HCl(浓) 2KCl+2MnCl2+5Cl2↑+8H2O制取并收集纯净、干燥的氯气,部分装置如图所示:
|
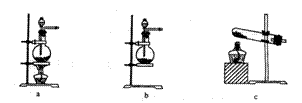
(1)若以KMnO4和浓盐酸为原料制取氯气,请根据反应原理从下图中选择合适的制气装置 (填代号)。
|
(2)装置B的作用是 。
(3)E中的试剂可选用 (填代号)。
A.NaOH溶液 B.Na2CO3溶液 C.NaCl溶液 D.水
(4)某学生通过下列两种方式制取氯气:
①用8.7gMnO2与足量浓盐酸反应制取Cl2
②用含14.6gHCl的浓盐酸与足量MnO2反应制取Cl2
这两种方式产生Cl2的量的关系是 。
A.①多 B.②多 C.①②一样多
II.现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题:
(1)写出发生反应的离子方程式 ;
|
[V(CO2)]与时间(t)的关系如图
所示,试分析判断OE段、EF段、
FG段反应速率[分别用![]() (OE)、
(OE)、![]()
(EF)、![]() (FG)表示]的大小关系
(FG)表示]的大小关系
;比较OE段和EF
段,说明EF段速率变化的主要原因
应该是 。
 Ⅰ现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题:
Ⅰ现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题: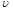 (OE)、
(OE)、
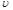 (OE)、
(OE)、