题目内容
【题目】在一隔热系统中,向20.00mL0.01000molL-1的醋酸溶液中逐滴加入0.01000mol.L-1的NaOH溶液,测得混合溶液的温度变化如图。下列相关说法正确的是( )
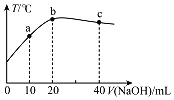
A. 若a点溶液呈酸性,则a点有:c(CH3COO-)>c(Na+)>c(CH3COOH)
B. 从b到c: 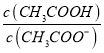 逐渐增大
逐渐增大
C. 水的电离程度:b点<c点
D. b点有0.01000molL-1 + c(H+)= c(Na+)-c(CH3COOH)+ c(OH-)
【答案】A
【解析】A、a点溶液中的溶质为等浓度的醋酸和醋酸钠,溶液显酸性,说明醋酸的电离大于醋酸钠的水解,所以a点有c(CH3COO-)>c(Na+)>c(CH3COOH),故A正确;B、b点恰好完全反应生成CH3COONa,从b点到c点,NaOH过量,抑制醋酸根离子的水解,醋酸的浓度减小,所以 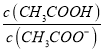 逐渐减小,故B错误;C、b点恰好完全反应生成CH3COONa,水解促进水电离,C点NaOH浓度增大,抑制水电离,水的电离程度:b点>c点,故C错误;D、b点恰好完全反应生成CH3COONa,CH3COONa浓度为0.005000mol/L,溶液中离子有电荷守恒c(Na+ )c(H+ )=C(CH3COO― )+c(OH― ),物料守恒:c(Na+ )=C(CH3COOH)+C(CH3COO― ),则有0.005000molL-1 + c(H+)= c(Na+)-c(CH3COOH)+ c(OH-),故D错误;故选A。
逐渐减小,故B错误;C、b点恰好完全反应生成CH3COONa,水解促进水电离,C点NaOH浓度增大,抑制水电离,水的电离程度:b点>c点,故C错误;D、b点恰好完全反应生成CH3COONa,CH3COONa浓度为0.005000mol/L,溶液中离子有电荷守恒c(Na+ )c(H+ )=C(CH3COO― )+c(OH― ),物料守恒:c(Na+ )=C(CH3COOH)+C(CH3COO― ),则有0.005000molL-1 + c(H+)= c(Na+)-c(CH3COOH)+ c(OH-),故D错误;故选A。

练习册系列答案
 目标测试系列答案
目标测试系列答案
相关题目