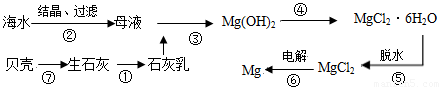
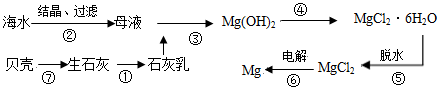题目内容
从海水中提取镁的工业流程如下图所示,下列说法正确的是
| A.在实验室进行②的操作需用到坩埚、坩埚钳、玻璃棒、酒精灯 |
| B.步骤⑥电解MgCl2时,阴极产生H2 |
| C.步骤⑤应将晶体置于HCl气体氛围中脱水 |
| D.上述工艺流程中的反应未涉及氧化还原反应 |
C
解析试题分析:蒸发溶液时应该用蒸发皿,而不是坩埚,坩埚用于固体的加热,A不正确;镁是活泼的金属,应该电解熔融的氯化镁,阴极生成镁,阳极生成氯气,B不正确;氯化镁在溶液中存在水解平衡,而水解是吸热的,且生成的氯化氢极易挥发,所以直接加热得不到氯化镁,因此选项C正确,目的是抑制镁离子的水解;D不正确,⑥是氧化还原反应,答案选C。
考点:考查海水的综合应用、仪器的选择、电解产物的判断、水解的应用及氧化还原反应的判断等
点评:本题容易错选选项A,这是由于不能正确理解蒸发皿和坩埚的使用范围造成的。蒸发皿用来蒸发水分、浓缩溶液等,例如提纯食盐等;坩埚用来煅烧、熔融固体的,有瓷坩埚及金属坩埚之分,金属坩埚有镍坩埚、金坩埚及铂坩埚等,可耐受某些强氧化剂、强酸或强碱的侵蚀。

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案
相关题目
从海水中提取镁的工业生产流程如下:
海水
Mg(OH)2
MgCl2?6H2O
MgCl2
下列说法错误的是( )
海水
| 石灰乳 |
| ① |
| 盐酸、加热浓缩 |
| ② |
| HCl气体、△ |
| ③ |
| 电解 |
| ④ |
下列说法错误的是( )
| A、此法的优点之一是原料来源丰富 |
| B、该提取镁的过程中涉及置换、分解、复分解和氧化还原反应 |
| C、步骤①②③的目的是从海水中提取无水MgCl2 |
| D、步骤②中加盐酸的离子方程式为Mg(OH)2+2H+=Mg2++2H2O |