题目内容
【题目】在四种不同条件下测得反应2SO2+O2![]() 2SO3的反应速率如下表所示:
2SO3的反应速率如下表所示:
编号 | (1) | (2) | (3) | (4) |
反应速率[mol/(L·min)] | v(SO2) | v(O2) | v(SO3) | v(O2) |
0.4 | 0.25 | 0.5 | 0.3 |
其中反应速率最快的是( )
A.(1) B.(2) C.(3) D.(4)
【答案】D
【解析】由反应速率之比等于相应物质的化学计量数之比可得:![]() v(SO2)=v(O2)=
v(SO2)=v(O2)=![]() v(SO3),将所得数据作如下换算:(1)
v(SO3),将所得数据作如下换算:(1)![]() v(SO2)=0.2 mol/(L·min);
v(SO2)=0.2 mol/(L·min);
(2)v(O2)=0.25 mol/(L·min);(3)![]() v(SO3)=0.25 mol/(L·min);(4)v(O2)=0.3 mol/(L·min),单位相同,数值大者反应速率快。
v(SO3)=0.25 mol/(L·min);(4)v(O2)=0.3 mol/(L·min),单位相同,数值大者反应速率快。

【题目】某同学用中和滴定法去测定某烧碱的纯度,实验过程如下:
(i)配制待测液称取得 5.0g 固体烧碱样品(杂质不与酸反应)配制成 250mL 溶液,
(ii)用 0.2000molL﹣1 标准盐酸滴定待测烧碱溶液,实验操作如下 A.用碱式滴定管取上述烧碱溶液10.00mL,注入锥形瓶中,加入指示剂.B.用待测定 的溶液润洗碱式滴定管.C.用蒸馏水洗干净滴定管.D.取下酸式滴定管用标准的盐酸 溶液润洗后,将标准液注入酸式滴定管刻度“0”以上2~3cm处,再把酸式滴定管固定好,调节液面至刻度“0”或“0”刻度以下.E.检查滴定管是否漏水.F.另取锥形瓶,再重复 操作一次.G.把锥形瓶放在滴定管下面,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面的刻度.
(1)①滴定操作的正确顺序是(用序号填写): .
②该滴定操作中应选用的指示剂是: .
③在G操作中如何确定终点?
(2)数据处理
实验次数编号 | 盐酸溶液体积V(mL) | 氢氧化钠溶液体积 V(mL) |
1 | 22.4 | 10.00 |
2 | 22.60 | 10.00 |
3 | 26.00 | 10.00 |
4 | 22.50 | 10.00 |
根据上述各数据,选取合适的三组,计算待测烧碱溶液的浓度为 , 烧碱 的纯度为
(3)下列操作,会导致实验结果偏低的是(填序号).
①碱式滴管用蒸馏水洗净后没有用待测液润洗 ②锥形瓶用蒸馏水洗净后没有用待测液润洗 ③终点读数时俯视(滴定前读数准确) ④酸式滴定管尖端气泡没有排除,滴定后消失 ⑤振荡时锥形瓶中液滴飞溅出来 ⑥酸式滴定管用蒸馏水洗净后没有用标准液润洗.
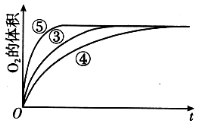
【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是__________________________。
(2)实验①和②的目的是_____________________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_____________________。
(3)写出实验③的化学反应方程式:______________。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论是____________________________。