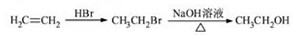题目内容
0.096mol的CO和0.075mol的O2在100mL的密闭容器中混合,加热到某一温度发生反应并达到平衡时,有0.08mol的CO2生成.
①计算该温度时的上述反应中平衡常数.
②如向平衡混合物中加入氧气时,CO的转化率会______,平衡常数______.
①计算该温度时的上述反应中平衡常数.
②如向平衡混合物中加入氧气时,CO的转化率会______,平衡常数______.
①由于生成0.08molCO2,所以:消耗CO的物质的量为0.08mol,剩余0.016mol;消耗O2的物质的量为0.04mol;剩余0.035mol;容器体积为0.1L,因此:
达到化学平衡时,c(CO)=0.16mol?L-1;c(O2)=0.35mol?L-1;c(CO2)=0.8mol?L-1;
写出化学平衡常数的表达式为K
═
≈71.4,
故答案为:K=71.4.
②增大氧气浓度使化学平衡向右移动,CO转化的物质的量浓度增大,而起始浓度不变,所以转化率增大;温度没有变化,所以化学平衡常数不变.
故答案为:增大不变
达到化学平衡时,c(CO)=0.16mol?L-1;c(O2)=0.35mol?L-1;c(CO2)=0.8mol?L-1;
写出化学平衡常数的表达式为K
| c2(CO2) |
| c2(CO)?c(O2) |
| 0.82 |
| 0.162?0.35 |
故答案为:K=71.4.
②增大氧气浓度使化学平衡向右移动,CO转化的物质的量浓度增大,而起始浓度不变,所以转化率增大;温度没有变化,所以化学平衡常数不变.
故答案为:增大不变

练习册系列答案
相关题目

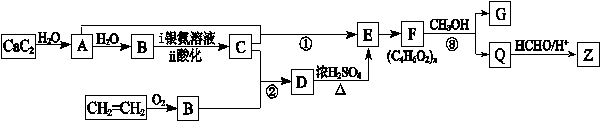
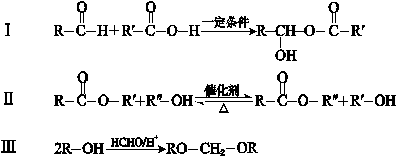
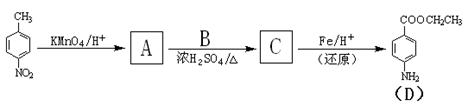
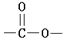 结构的基团
结构的基团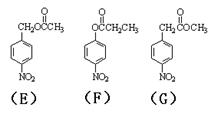
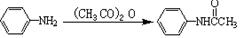

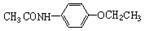 的流程图(无机试剂任选)。合成路线流程图示如下:
的流程图(无机试剂任选)。合成路线流程图示如下: