题目内容
【题目】工业上利用CO和![]() 制
制![]() 的反应为
的反应为![]() 。实验测得在两种不同压强下,CO的平衡转化率
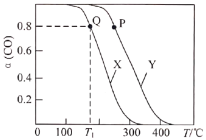
。实验测得在两种不同压强下,CO的平衡转化率![]() 与温度(T)的关系如图所示。查阅资料得:相同压强下,气体的分子数之比等于气体的体积之比。下列说法正确的是( )
与温度(T)的关系如图所示。查阅资料得:相同压强下,气体的分子数之比等于气体的体积之比。下列说法正确的是( )
A.反应![]() 的
的![]()
B.图中曲线X所对应的压强大于曲线Y所对应的压强
C.![]() ℃,
℃,![]() 时,平衡常数
时,平衡常数![]()
D.图中P点所示条件下,延长反应的时间能提高![]() 转化率
转化率
【答案】C
【解析】
A.由图象X或Y可知,随温度的升高,CO的转化率逐渐降低,说明平衡逆向移动,故正反应为放热反应,![]() ,故A错误;
,故A错误;
B.相同温度下,曲线X对应CO的转化率较Y低,若通过改变压强由曲线X至曲线Y,CO的转化率上升,即平衡向正向移动,该反应正向为气体体积减小的反应,因此由X至曲线Y为增大压强,故曲线X对应的压强小于曲线Y对应的压强,故B错误;
C.设起始容器体积为1L,T1℃下平衡时CO的转化率为80%,平衡时n(CO)=( 1-1×80%)mol=0.2mol,n(H2)=(2-1×80%×2)mol=0.4mol,n(CH3OH)=0.8mol,n总=(0.2+0.4+0.8)mol=1.4mol,此时容器的体积为:![]() =
=![]() L,c(CO)=
L,c(CO)=![]() mol/L,c(H2)=
mol/L,c(H2)=![]() mol/L,c(CH3OH)=
mol/L,c(CH3OH)=![]() mol/L,平衡常数
mol/L,平衡常数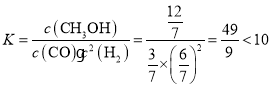 ,故C正确;
,故C正确;
D.P点反应已达到平衡状态,延长反应时间并不会改变平衡状态,不会提高CO转化率,故D错误;
故答案为:C。

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目