题目内容
【题目】为了有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物含量、使用清洁能源显得尤为重要。
(1)已知:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) H = -905.48 kJ·mol-1
4NO(g)+6H2O(g) H = -905.48 kJ·mol-1
N2(g)+O2(g)![]() 2NO(g) H = +180.50 kJ·mol-1
2NO(g) H = +180.50 kJ·mol-1
则4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g)的H = 。
5N2(g)+6H2O(g)的H = 。
(2)某化学小组查阅资料知2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
第一步:2NO(g)![]() N2O2(g) (快) H1<0 v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
N2O2(g) (快) H1<0 v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
第二步:N2O2(g)+O2(g)![]() 2NO2(g) (慢) H2< 0
2NO2(g) (慢) H2< 0
v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
① 2NO(g)+O2(g)![]() 2NO2(g)的反应速率主要是由_______(填“第一步”或“第二步”)反应决定。
2NO2(g)的反应速率主要是由_______(填“第一步”或“第二步”)反应决定。
② 一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K= ;升高温度,K值 (填“增大”、“减 小”或“不变”)
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K= ;升高温度,K值 (填“增大”、“减 小”或“不变”)
(3)利用活性炭涂层排气管处理NOx的反应为:xC(s)+2NOx(g)![]() N2(g)+xCO2(g) △H <0;理论上,适当增加汽车排气管(内壁为活性炭涂层)长度______(填“能”或“不能”)使NOx更加有效地转化为无毒尾气而排放,其原因是 。
N2(g)+xCO2(g) △H <0;理论上,适当增加汽车排气管(内壁为活性炭涂层)长度______(填“能”或“不能”)使NOx更加有效地转化为无毒尾气而排放,其原因是 。
(4)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应: C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示,则800℃时,反应达平衡时CO2的转化率为________(保留一位小数)。
2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示,则800℃时,反应达平衡时CO2的转化率为________(保留一位小数)。

(5)氢气是一种重要的清洁能源,Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为 。
【答案】(1)-1807.98kJ·mol-1;
(2)①第二步;②![]() ,减小;
,减小;
(3)能,增加排气管长度,增大了NOx与活性炭涂层的接触面积,能加快化学反应速率,使反应更充分;
(4)86.9%;(5)2Mg2Cu+3H2![]() MgCu2+3MgH2。
MgCu2+3MgH2。
【解析】
试题分析:(1)①4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),②N2(g)+O2(g)
4NO(g)+6H2O(g),②N2(g)+O2(g)![]() 2NO(g),①-5×②得出4NH3(g)+6NO(g)
2NO(g),①-5×②得出4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) △H=(-905.48-180.5×5)kJ·mol-1=-1807.98kJ·mol-1;(2)①反应慢的决定反应速率;②根据平衡常数的表达式,K=c2(NO2)/(NO2)/[c2(NO)×c(O2)]=
5N2(g)+6H2O(g) △H=(-905.48-180.5×5)kJ·mol-1=-1807.98kJ·mol-1;(2)①反应慢的决定反应速率;②根据平衡常数的表达式,K=c2(NO2)/(NO2)/[c2(NO)×c(O2)]= 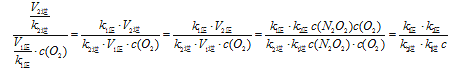 ;正反应是放热反应,升高温度,平衡向逆反应方向移动,即K减小;(3)能,增加排气管长度,增大了NOx与活性炭涂层的接触面积,能加快化学反应速率,使反应更充分;
;正反应是放热反应,升高温度,平衡向逆反应方向移动,即K减小;(3)能,增加排气管长度,增大了NOx与活性炭涂层的接触面积,能加快化学反应速率,使反应更充分;
(4)C(s)+CO2(g)![]() 2CO(g)
2CO(g)
起始: a 0
变化: x 2x
平衡: a-x 2x,
因此有2x/(a-x+2x)×100%=93%,解得a/x=0.93/1.07,即CO2的转化率为86.9%;(5)Mg比铜活泼,因此得到氢化物是氢和镁,根据物质的量之比:(1-0.077)/24:0.077/1≈1:2,化学式为MgH2,反应方程式为:2Mg2Cu+3H2![]() MgCu2+3MgH2 。
MgCu2+3MgH2 。

 名校课堂系列答案
名校课堂系列答案