题目内容
【题目】随着卤素原子核电荷数的增加,下列递变规律正确的是
A. 单质的熔沸点逐渐降低B. 气态氢化物的稳定性逐渐降低
C. 卤素最高价含氧酸酸性逐渐增强D. 卤素单质的氧化性逐渐增强
【答案】B
【解析】
A、卤族元素从上到下,单质的熔沸点逐渐升高,故A错误;
B、卤族元素从上到下,元素的非金属性逐渐减弱,气态氢化物的稳定性减弱,故B正确;
C、卤素最高价含氧酸酸中高氯酸的酸性最强,故C错误;
D、卤族元素从上到下,元素的非金属性逐渐减弱,对应单质的氧化性逐渐减弱,故D错误;

【题目】铝热反应是铝的一个重要性质,该性质用途十分广泛.“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”.已知:Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如表:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
沸点/℃ | 2 467 | 2 980 | 2 750 | ﹣ |
(1)I.某同学推测,铝热反应所得到的熔融物应是铁铝合金.理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.你认为他的解释是否合理?(填“合理”或“不合理”).
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是 , 反应的离子方程式为 .
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是(填序号).
A.浓硫酸
B.稀硫酸
C.稀硝酸
D.氢氧化钠溶液
(4)Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入6molL﹣1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题: 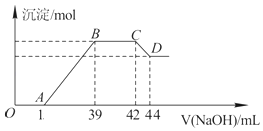
依题意,请写出熔融物中铁与该稀的硝酸反应的离子方程式:
(5)图中OA段没有沉淀生成,此阶段发生反应的离子方程式为 .
(6)在BC段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为;
(7)熔融物中铝元素的物质的量为mol.
(8)B点对应的沉淀的物质的量为mol,A点对应的氢氧化钠溶液的体积为mL.