题目内容
【题目】某校化学兴趣小组同学为探究二氧化氮的氧化性和还原性,设计了如下装置:
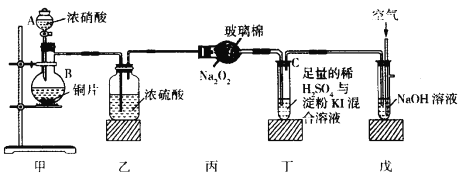
已知:2NO2+2NaOH=NaNO2+NaNO3+H2O NO2+NO+2NaOH=2NaNO2+H2O
请回答下列问题:
(1)盛放浓硝酸装置的名称是____________________________。
(2)装置乙的作用是______________________________________。
(3)装置丙中的实验现象为淡黄色固体变为白色,其反应为Na2O2+2NO2![]() 2NaNO3,该实验证明NO2具有_________________性。
2NaNO3,该实验证明NO2具有_________________性。
(4)丁装置证明NO2具有氧化性,其实验现象为________________________________,反应的化学方程式为__________________________________________。
(5)装置戊中通入空气的目的为_______________________________________。
(6)若要证明装置丁的试管C中发生反应后的某种产物具有氧化性,你的实验设计方案为_________。
(7)该小组同学用酸性KMnO4溶液可测定反应后装置戊中NaNO2的含量(其他物质不与反应)。用___________(填写“酸式”或“碱式”)滴定管取amol/L酸性KMnO4溶液滴定装置戊中反应后的溶液V2mL,消耗酸性KMnO4溶液V1mL,则反应后装置戊中NaNO2的含量为__________g/mL。
【答案】 分液漏斗 除去生成NO2中含有的水蒸气 还原 溶液变蓝 NO2+2KI+H2SO4=K2SO4+I2+NO+H2O 将NO转化成NO2被NaOH溶液吸收,防止污染环境 取下装置丁的试管C,向其中加入足量Na2SO3溶液,溶液颜色褪去,证明I2具有氧化性 酸式 0.1725aV1/V2
【解析】(1)盛放浓硝酸装置的名称是分液漏斗;(2)浓硫酸具有吸水性,装置乙的作用是除去生成NO2中含有的水蒸气;(3)Na2O2+2NO2![]() 2NaNO3,NO2中N由+4价升为+5价,该实验证明NO2具有还原性。(4)NO2+2KI+H2SO4=K2SO4+I2+NO+H2O,I2能使淀粉呈蓝色,(5)装置戊中通入空气的目的为将NO转化成NO2被NaOH溶液吸收,防止污染环境;(6)证明装置丁的试管C中发生反应后的某种产物具有氧化性,取下装置丁的试管C,向其中加入足量Na2SO3溶液,溶液颜色褪去,证明I2具有氧化性。(7)酸性KMnO4具有强氧化性,要用酸式滴定管盛装,则根据方程式5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O可知,亚硝酸钠的物质的量是aV1×10-3mol×5/2,其质量为aV1×10-3mol×5/2×69g·mol-1=0.1725aV1g,反应后装置戊中NaNO2的含量为0.1725aV1/V2g/mL。
2NaNO3,NO2中N由+4价升为+5价,该实验证明NO2具有还原性。(4)NO2+2KI+H2SO4=K2SO4+I2+NO+H2O,I2能使淀粉呈蓝色,(5)装置戊中通入空气的目的为将NO转化成NO2被NaOH溶液吸收,防止污染环境;(6)证明装置丁的试管C中发生反应后的某种产物具有氧化性,取下装置丁的试管C,向其中加入足量Na2SO3溶液,溶液颜色褪去,证明I2具有氧化性。(7)酸性KMnO4具有强氧化性,要用酸式滴定管盛装,则根据方程式5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O可知,亚硝酸钠的物质的量是aV1×10-3mol×5/2,其质量为aV1×10-3mol×5/2×69g·mol-1=0.1725aV1g,反应后装置戊中NaNO2的含量为0.1725aV1/V2g/mL。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案