题目内容
【题目】已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,下列说法正确的是
A.H2(g)的燃烧热为571.6 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)=
Ba(OH)2(aq)=![]() BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
【答案】B
【解析】
A. 燃烧热是指1mol纯物质完全燃烧生成稳定的氧化物所放出的热量,所以H2的燃烧热为1/2×571.6kJ/mol,故A错误;
B. 令H2(g)和CH3OH(l)的质量都为1g,则1g氢气燃烧放热为1/2×1/2×571.6=142.45kJ,1gCH3OH燃烧放热为1/32×1/2×1452=22.68kJ,所以H2(g)放出的热量多,故B正确;
C. 中和热是强酸强碱的稀溶液完全反应生成1mol水时放出的热量,故C错误;
D.2H2(g)+O2(g)═2H2O(l)△H=571.6kJmol-1改写为3H2(g)+3/2O2(g) ═ 3H2O(l) △H=(3/2×571.6)kJmol1,2CH3OH(l)+3O2(g) ═ 2CO2(g)+4H2O(l) △H=1452kJmol1改写为CO2(g)+2H2O(l) = CH3OH(l)+3/2O2(g)) △H=+(1/2×1452)kJmol1改写后的方程相加即得3H2(g)+CO2(g) = CH3OH(l)+H2O(l),所以其△H═(3/2×571.6)+(1/2×1452)=131.4kJmol1,故D错误;
故选B。

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案【题目】目前我国研制的稀土催化剂催化转化汽车尾气示意图如下:
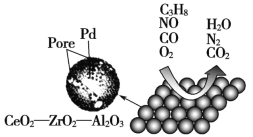
(1)Zr原子序数为40,价电子排布式为4d25s2,它在周期表中的位置是_______________。
(2)图中互为等电子体的两种气体分子是_____________。
(3)C3H8中所有碳原子的杂化方式是___________。
(4)图中属于非极性的气体分子是_______________________。
Fe、Mn元素的部分电离能数据列于下表中
元素 | Fe | Mn | |
电离能(kJ·mol-1) | I1 | 759 | 717 |
I2 | 1561 | 1509 | |
I3 | 2957 | 3248 | |
(5)从上表两元素部分电离能数据比较的可知,气态Mn2+再失去一下电子比气态Fe2+再夫去一个电子难,原因是_____________。
(6)CO与Ni可生成羰基镍[Ni(CO)4],已知其中镍的化合价为0,镍原子在基态时核外电子排式为_____________,[Ni(CO)4]的配体是_________,配位原子是__________。
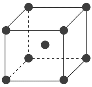
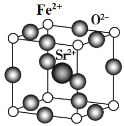
(7)为了节省贵金属并降低成本,也常用钙钛矿型复合氧化物作为催化剂。一种复合氧化物结构如图所示,则与每个Sr2+紧邻的O2-有______个。
(8)与Zr相邻的41号元素Nb金属的晶格类型为体心立方晶格,原子半径为apm,相对原子质量为b,阿伏加德罗常数为NA,试计算晶体铌的密度为______________g·cm-3(用来a、b、NA表示计算结果)。