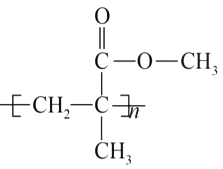
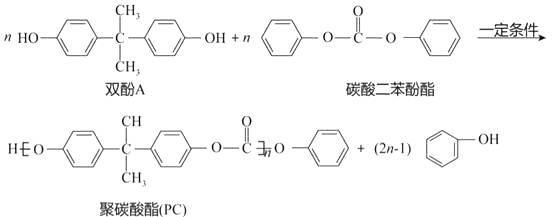
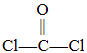题目内容
【题目】有原子序数依次增大的 A、B、C、D、E、F 六种短周期元素;A 元素的原子半径是所有元素中原子最小的; C 元素的最高价氧化物对应水化物与其氢化物能生成盐 M;E 与 A 同主族,F 元素原子的最外层电子数比次外层电子数少 2;A、B、C、E、F这五种元素,每﹣种与 D 元素都能形成原子个数比不相同的若干种化合物.请回答:
(1)D 元素在周期表中的位置为 .
(2)可以比较 D 和 F 得电子能力强弱的是(填写编号).
a.比较这两种元素原子半径的大小
b.二者形成的化合物中,D 元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(3)盐 M 中含有的化学键类型有;并写出其中阳离子的电子式 .
(4)固体氧化物燃料电池(SOFC)以固体氧化物作为电解质.其工作原理如下图所示.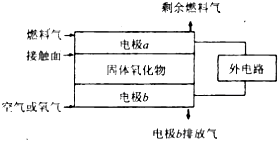
①固体氧化物中的 O2﹣向(填“正”或“负”)极移动.
②电极 b 为电池极
③若A2 作为燃料气,则接触面上发生的反应为 .
④若B2A4作为燃料气,则接触面上发生的反应为 .
【答案】
(1)第二周期第VIA族
(2)bc
(3)离子键、共价键,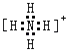
(4)负,正,H2+O2﹣﹣2e﹣=H2O,C2H4+6O2﹣﹣12e﹣=2CO2+2H2O
【解析】解:有原子序数依次增大的A、B、C、D、E、F六种短周期元素,A元素的原子半径是所有元素中原子最小的,所以A为H元素;C元素的最高价氧化物对应水化物与其氢化物能生成盐M,则C是N元素;E与A同主族,E的原子序数大于C,所以E为Na元素;F元素原子的最外层电子数比次外层电子数少2,则F为S元素;A、B、C、E、F这五种元素,每﹣种与D元素都能形成原子个数比不相同的若干种化合物,则D为O元素,B为C元素.
(1)通过以上分析知,D是O元素,O元素位于第二周期第VIA族,
所以答案是:第二周期第VIA族;
(2)比较D和F得电子能力强弱实际上就是比较两种元素的非金属性强弱,比较非金属性强弱的方法有:比较与氢气化合的难易程度、比较氢化物的稳定性、比较两种元素形成的化合物中的化合价、电负性等,
故选bc;
(3)硝酸铵中 铵根离子和硝酸根离子之间存在离子键,铵根离子中氮原子和氢原子、硝酸根离子中氮原子和氧原子之间都存在共价键,铵根离子的电子式为: 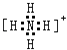 ,
,
所以答案是:离子键、共价键; 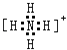 ;
;
(4)①原电池放电时阴离子向负极移动,所以O2﹣向负极移动,
所以答案是:负;
②燃料电池中,正极上投放氧化剂,所以b电极是正极,
所以答案是:正;
③如果氢气为燃料,则该电极上氢气失电子和氧离子反应生成水,则电极反应式为H2+O2﹣﹣2e﹣=H2O,
所以答案是:H2+O2﹣﹣2e﹣=H2O;
④如果C2H4作为燃料气,该电极上燃料失电子和氧离子反应生成二氧化碳和水,所以电极反应式为C2H4+6O2﹣﹣12e﹣=2CO2+2H2O,
所以答案是:C2H4+6O2﹣﹣12e﹣=2CO2+2H2O.

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案