题目内容
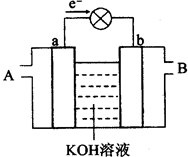
某同体酸燃料电池以Ca(HSO4)2固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2=2H2O,下列有关说法错误的是


| A.电子通过外电路从a极流向b极 |
| B.b极上的电极反应式为:O2+4H++4e-=2H2O |
| C.每转移0.4 mol电子,生成3.6g水 |
| D.H+由b极通过固体酸电解质传递到a极 |
D
试题分析:A、a通入氢气为负极,b通入氧气是正极,则电子应该是通过外电路由a极流向b,正确;B、该电池电解质为Ca(HSO4)2固体,正极电极反应为O2+4e-+4H+=2H2O,正确;C、根据化学反应方程式可知:H2O—2e?,则每转移0.4 mol电子,生成0.2mol水,质量是0.2mol×18g/mol=3.6g,正确;D、原电池中,阳离子向正极移动,所以H+由a极通过固体酸电解质传递到b极,错误。

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目


 2Fe3+
2Fe3+