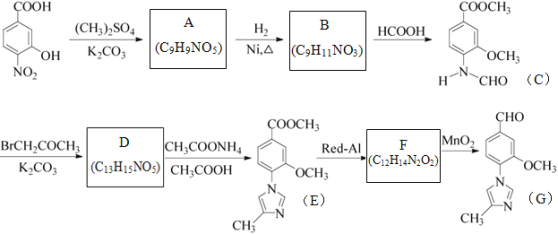
题目内容
【题目】已知H2(g)+2ICl(g)![]() I2(g)+2HCl(g),该反应分①、②两步进行,其能量曲线如图所示,
I2(g)+2HCl(g),该反应分①、②两步进行,其能量曲线如图所示,
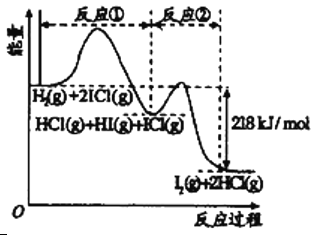
下列有关说法正确的是
A. 反应①为吸热反应
B. 反应①和②均是同种元素间发生的氧化还原反应
C. 反应①比反应②的速率慢,与图中相应峰高有关
D. HI(g)+ICl(g) ![]() I2(g)+HCl(g)生成1摩尔HCl放出218kJ的热量
I2(g)+HCl(g)生成1摩尔HCl放出218kJ的热量
【答案】C
【解析】
A.由图可知,反应①和反应②中反应物总能量都大于生成物,则反应①、反应②均为放热反应,故A错误;
B.反应①中氢气参与反应,化合价升高被氧化,ICl中的I化合价降低被还原,不是同种元素间发生的氧化还原反应,故B错误;
C.由图可知,反应①中正反应的活化能大,反应②中正反应的活化能小,反应①比反应②的速率慢,故C正确;
D.由图可知,反应HI(g)+ICl(g) ![]() I2(g)+HCl(g) 的反应物总能量和生成物总能量差值小于218 kJ,则生成1摩尔HCl放出的热量小于218 kJ,故D错误。
I2(g)+HCl(g) 的反应物总能量和生成物总能量差值小于218 kJ,则生成1摩尔HCl放出的热量小于218 kJ,故D错误。
故选C。

练习册系列答案
相关题目