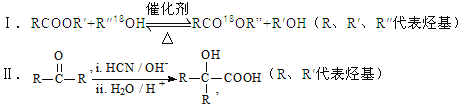��Ŀ����
����Ŀ����0.1 mol��þ�������������100 mL2 mol/L��H2SO4��Һ�У�Ȼ���ٵμ�1 mol/LNaOH��Һ����ش�
��1�����ڵμ�NaOH��Һ�Ĺ����У���������m �����NaOH��Һ�����V�仯��ͼ��ʾ����V1=160 mL ʱ���������ĩ��n(Mg) = __________mol ��V2��_________mL ��
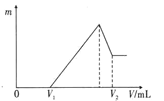
��2�����ڵμ�NaOH��Һ�����У���ʹMg2+��Al3+�պó�����ȫ�������NaOH��Һ�����V (NaOH) = __________mL ��
��3�����������Ϊ0.1mol������Mg�۵����ʵ�������Ϊa����100 mL 2 mol/L�������ܽ�˻������ټ���450 mL 1 mol/L��NaOH��Һ�����ó�������Al(OH)3�������������a��ȡֵ��Χ�ǣ�____________��
���𰸡���1��0.06mol��440mL ��2��400mL ��3��0.5��a<1��
��������
�����������1��100mL 2molL-1��H2SO4��Һ����������ʵ���Ϊ0.1L��2mol/L=0.2mol��
��V1=160mLʱ����ʱ����Һ��MgSO4��Al2(SO4)3��Na2SO4���Һ��
��Na+�����غ��֪��n(Na2SO4)=1/2n(Na+)=1/2n(NaOH)=1/2��0.16L��1mol/L=0.08mol
��MgSO4Ϊxmol��Al2(SO4)3Ϊymol����
����Mgԭ�ӡ�Alԭ���غ��У�x+2y=0.1
����SO42-�����غ��У�x+3y=0.2-0.08
�������̣���ã�x=0.06��y=0.02
���Խ�����ĩ��n(Mg)=0.06mol��n(Al)=2y=2��0.02mol=0.04mol
�μ�NaOH��Һ�����V2ʱ����Һ��Na2SO4��NaAlO2���Һ������SO42-���ӡ�Na+���Ӻ�Alԭ���غ��У�
n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al)=2��0.2mol��+0.04mol=0.44mol�����ԣ�V2=0.44mol��1mol/L=0.44L=440mL��
��2������Һ��Mg2+��Al3+ǡ�ó�����ȫʱ����ʱ��Һ��Na2SO4��Һ������SO42-���Ӻ�Na+�����غ��У�n(Na+)=2n(Na2SO4)=2(H2SO4)=2��0.1L��2mol/L=0.4mol������V(NaOH)=0.4mol��1mol/L=0.4L=400ml��
��3������Ϊ����������a��1��Al�����ʵ���Ϊ0.1(1-a)mol����Ӧ��Ļ����Һ���ټ���450mL 1mol/L��NaOH��Һ�����ó�������Al(OH)3������Ϊ�����ơ�ƫ�����ƣ�������Ԫ���غ��֪n(NaAlO2)=0.1(1-a)mol�������������غ㣬Ӧ����n(NaOH)��2n(Na2SO4)+n(NaAlO2)����0.45��1��2��0.1��2+0.1(1-a)�����a��0.5����0.5��a��1��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�