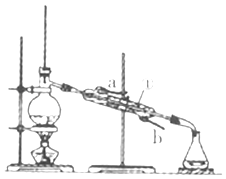
题目内容
【题目】氨基甲酸铵(NH2COONH4) 是一种易分解、易水解的白色固体,某研究小组用如图1所示的实验装置,模拟工业原理用氢氧化钠晶体、浓氨水、干冰等作原料制备氨基甲酸铵.主要反应原理为:2NH3(g)+CO2(g)H2NCOONH4(s)△H<0 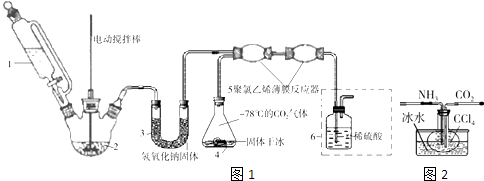
(1)仪器1盛装的试剂是 . 仪器3的名称是 , 其中NaOH固体的作用是 .
(2)装置6(虚线方框内部分)的一个作用是控制原料气按反应计量系数充分反应,若反应初期观察到装置内稀硫酸溶液中产生气泡,应该(填“加快”、“减慢”或“不改变)产生氨气的流速.
(3)另有一种传统制备氨基甲酸铵的反应器(CCl4充当惰性反应介质) 如下:
①写出氨基甲酸铵受热分解成尿素CO(NH2)2的方程式 .
②当CCl4液体中产生较多晶体悬浮物时,即停止反应,过滤分离得到粗产品,为了将所得粗产品干燥可采取的方法是()
A.蒸馏 B.常压加热烘于 C.高压加热烘于 D.真空微热烘于
(4)实验中如图2发现用玻璃烧瓶做反应器,内壁容易形成致密坚硬、粘附能力强的产物结晶体.研究小组采用聚氯乙烯薄膜材料的反应器,优点是()
A.可避免产物粘附时内壁影响散热
B.可以揉搓方便收集产品
C.性质稳定
(5)氨基甲酸铵变质后会转化为碳酸氢铵.取1.173g变质后的样品,加入足量澄清石灰水,使样品中碳元素全部转化为碳酸钙,过滤、洗涤、干燥得到沉淀1.500g.该样品中氨基甲酸铵物质的质量分数为 .
【答案】
(1)浓氨水;U型管;干燥氨气
(2)加快
(3)NH2COONH4 ![]() CO(NH2)2+H2O;D
CO(NH2)2+H2O;D
(4)AB
(5)79.8%
【解析】解:(1)三颈烧瓶内制备氨气,反应由液体与固体不加热制备氨气,可以是浓氨水与碱制备,由于氨基甲酸铵易水解,U型管内氢氧化钠干燥氨气,在5中反应得到氨基甲酸铵,6中稀硫酸进行尾气处理,所以答案是:浓氨水;U型管;干燥氨气;(2)若反应初期观察到装置内稀硫酸溶液中产生气泡,说明有二氧化碳排出,通入氨气的量不足,应该适当加快产生氨气的流速,
所以答案是:加快;(3)①氨基甲酸铵受热分解成尿素CO(NH2)2 , 由原子守恒可知还生成水,反应方程式为:NH2COONH4 ![]() CO(NH2)2+H2O,
CO(NH2)2+H2O,
所以答案是:NH2COONH4 ![]() CO(NH2)2+H2O;
CO(NH2)2+H2O;
②氨基甲酸铵受热易分解,采取减压低温烘干,即真空微热烘于,
所以答案是:D;(4)用玻璃烧瓶做反应器,内壁容易形成致密坚硬、粘附能力强的产物结晶体,不利于产品收集,不利于内壁影响散热,合成H2NCOONH4的反应为放热反应,温度过高不利于H2NCOONH4的生成,改用聚氯乙烯薄膜材料的反应器,可以避免上述情况,
故选:AB;(5)样品中碳元素全部转化为碳酸钙,碳酸钙的物质的量为 ![]() =0.015mol,设氨基甲酸铵、碳酸氢铵的物质的量分别为xmol、ymol,
=0.015mol,设氨基甲酸铵、碳酸氢铵的物质的量分别为xmol、ymol,
根据碳原子守恒,则x+y=0.015
根据总质量可知,则78x+79y=1.173
解得x=0.012,y=0.003
0.012mol×78g/mol=0.936g,
样品中氨基甲酸铵的质量分数= ![]() ×100%=79.8%,
×100%=79.8%,
所以答案是:79.8%

 名校课堂系列答案
名校课堂系列答案