题目内容
8分)Cu2S和稀HNO3反应生成Cu(NO3)2、H2SO4、NO和H2O,试解答下列各题
(1)配平上述反应方程式并标出电子转移的方向和总数
(2)当产生0.1mol NO时,转移电子总数为 ,被还原的物质为 mol,共耗HNO3 mol。
(3)被1mol Cu2S中+1价亚铜离子还原的HNO3的物质的量是 mol
(1)配平上述反应方程式并标出电子转移的方向和总数
(2)当产生0.1mol NO时,转移电子总数为 ,被还原的物质为 mol,共耗HNO3 mol。
(3)被1mol Cu2S中+1价亚铜离子还原的HNO3的物质的量是 mol
|

 (1)3Cu2S+22HNO3(稀)═6Cu(NO3)2+10NO↑+3H2SO4+8H2O
(1)3Cu2S+22HNO3(稀)═6Cu(NO3)2+10NO↑+3H2SO4+8H2O
| |||
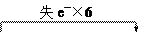 | |||

 或:3Cu2S+22HNO3(稀)═6Cu(NO3)2+10NO↑+3H2SO4+8H2O
或:3Cu2S+22HNO3(稀)═6Cu(NO3)2+10NO↑+3H2SO4+8H2O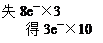 |
(2) 0.3×6.02×1023或1.806×1023 ;0.1;0.22 ;(3)
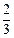 ;
;略

练习册系列答案
相关题目
 MnCl2+Cl2↑+2H2O,该反应中氧化剂与还原剂的物质的量之比为 ,请将该化学方程式改写为离子方程式______________________________,氯气的工业制法是电解饱和食盐水,请列举出氯气在生产、生活中的应用(两条)_________________,___________________;
MnCl2+Cl2↑+2H2O,该反应中氧化剂与还原剂的物质的量之比为 ,请将该化学方程式改写为离子方程式______________________________,氯气的工业制法是电解饱和食盐水,请列举出氯气在生产、生活中的应用(两条)_________________,___________________; Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O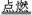 2CO2
2CO2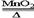 2KCl+3O2↑
2KCl+3O2↑ Fe2O3 +3H2O
Fe2O3 +3H2O 还原反应
还原反应