题目内容
【题目】取一定物质的量浓度的NaOH溶液100mL,然后向其通入一定量的CO2气体,得到溶液A,向A中逐滴缓慢加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况)与所加HCl溶液的体积之间关系如图所示,通过计算回答:
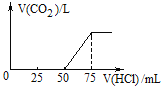
(1)A溶液中的溶质为_________(化学式),其物质的量之比是_______。
(2)通入CO2气体体积__________________(标准状况)。
(3)NaOH溶液的物质的量浓度______________________。
【答案】(1)NaOH、Na2CO3(2分),1:1(2分);
(2)56 mL(2分);(3)0.075mol/L(2分)。
【解析】
试题分析:(1)根据图像可知产生CO2消耗的盐酸溶液体积小于不产生CO2消耗的溶液体积,由于碳酸钠与盐酸反应分步进行,Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑。并且可以看出,当反应完全进行时,两个过程消耗HCl的量相等;若溶液中还有氢氧化钠,则首先发生反应:NaOH+HCl=NaCl+H2O,因此A中的溶质是氢氧化钠和碳酸钠;碳酸钠 转化为碳酸氢钠和碳酸氢钠产生CO2消耗的盐酸量相等,所以根据图像以及反应的方程式可知NaOH和Na2CO3的物质的量之比等于消耗盐酸的体积之比,则n(NaOH):n(Na2CO3)=(75mL-50mL):25mL=1:1;
(2)50mL~75mL发生的反应为NaHCO3+HCl=NaCl+H2O+CO2↑,
n(HCl)=0.025L×0.1mol/L=0.0025mol,
则V(CO2)=0.0025mol×22.4L/mol=0.056L=56mL;
(3)当加入盐酸75mL时,溶液溶质为NaCl,
此时n(Na+)=n(HCl)=0.075mL×0.1mol/L=0.0075mol,
所以n(NaOH)=0.0075mol,c(NaOH)=0.0075mol÷0.1L=0.075mol/L。

【题目】用如图所示装置进行下列实验,实验结果与预测的现象不一致的是

①中的物质 | ②中的物质 | 预测①的现象 | |
A | 淀粉KI溶液 | 浓硝酸 | 无明显变化 |
B | 酚酞溶液 | 浓盐酸 | 无明显变化 |
C | AlCl3溶液 | 浓氨水 | 有白色沉淀 |
D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
A. A B. B C. C D. D
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
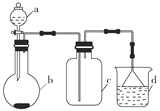
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 浓硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
A. A B. B C. C D. D