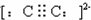题目内容
CaC2和MgC2都是离子化合物.下列叙述中正确的是( )
分析:A、根据碳化钙的性质判断碳化镁的性质;
B、根据离子键的成键情况判断;
C、根据是否与水反应判断;
D、根据化合物的所属类型判断;
B、根据离子键的成键情况判断;
C、根据是否与水反应判断;
D、根据化合物的所属类型判断;
解答:解:A、碳化钙和水反应,根据性质的相似性,碳化镁和水也反应生成乙炔,故A正确.
B、C22-的电子式为 ,故B正确.
,故B正确.
C、碳化钙和水反应生成氢氧化钙和乙炔,所以不能在水中以Ca2+和C22-形式存在,故C错误.
D、碳化镁是离子化合物,熔沸点较高,可能在100℃以上,故D错误.
故选AB.
B、C22-的电子式为
 ,故B正确.
,故B正确.C、碳化钙和水反应生成氢氧化钙和乙炔,所以不能在水中以Ca2+和C22-形式存在,故C错误.
D、碳化镁是离子化合物,熔沸点较高,可能在100℃以上,故D错误.
故选AB.
点评:本题以碳化钙为载体考查了离子化合物的结构特征与性质,我们虽然没学过碳化镁,但利用性质的相似性可以推断它的性质,要学会知识迁移的方法解决问题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目