题目内容
S2C12是一种金黄色易挥发的液体,具有强烈的窒息性,在工业生产上可用于橡胶的硫化。为在实验室合成S2C12,某化学研究性学习小组进行了以下探究。
【查阅资料】① 干燥的氯气在110℃~140℃与硫反应,即可得到S2C12。② S的熔点为112.8℃、沸点为444.6℃;S2C12的熔点为 76℃、沸点为138℃。
76℃、沸点为138℃。
③ S2C12+C12 2SCl2。④ S2C12易和水发生反应,生成H2S、SO2、H2SO3、H2SO4等。⑤ClO3-+5Cl-+6H
2SCl2。④ S2C12易和水发生反应,生成H2S、SO2、H2SO3、H2SO4等。⑤ClO3-+5Cl-+6H =3C12↑+3H2O 请回答下列问题:
=3C12↑+3H2O 请回答下列问题:
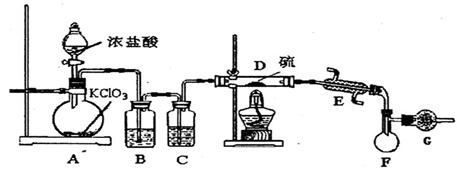
【实验装置设计】
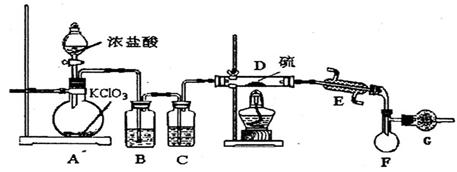
(1)B中所放试剂为 ; C中所放试剂为 。
(2)在加热D时温度不宜过高,其原因是 ;
为了提高S2C12的纯度,关键的操作是控制好温度和 ;
(3)G装置的作用是 ;
(4)写出工业上制漂白粉的化学方程式 ;
共14分
(1)饱和食盐水(1分) 浓硫酸(1分)
(2)产率降低(或防止发生副反应或产品纯度降低等)(1分)
控制盐酸的滴速不要过快(1分)
(3)防止空气中的水蒸气进入F,吸收尾气(2分)
(4)2C12 + 2Ca(OH)2 =CaC12 + Ca(C1O)2 + 2H2O (2分)
【解析】
试题分析:(1)A装置是制取C12,B是除去HCl气体,用的是饱和食盐水。C是干燥C12,用的是浓硫酸。
(2)S2C12+C12 2SCl2,故在加热D时温度不宜过高,其原因是产率降低(或防止发生副反应或产品纯度降低等)。为了提高S2C12的纯度,关键的操作是控制好温度和控制盐酸的滴速不要过快,充分反应。
2SCl2,故在加热D时温度不宜过高,其原因是产率降低(或防止发生副反应或产品纯度降低等)。为了提高S2C12的纯度,关键的操作是控制好温度和控制盐酸的滴速不要过快,充分反应。
(3)因为S2C12易和水发生反应,所以G装置的作用是防止空气中的水蒸气进入F,还有吸收尾气。
(4)依据课本知识熟悉方程式,2C12 + 2Ca(OH)2 =CaC12 + Ca(C1O)2 + 2H2O。
考点:氯气的实验室制法 氯气的化学性质 含硫物质的性质及综合应用.
点评:本题主要考查了在实验室中合成S2C12,根据题目信息分析原因,培养了学生运用知识的能力与解决问题的能力,综合性较强,难度大。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案S2C12是一种金黄色易挥发的液体,常用作橡胶硫化剂。某化学兴趣小组 拟设计实验制备少量的S2C12,査阅资料知S2Cl2在水中易发生歧化反应(一部分硫元素化 合价升高,另一部分化合价 降低)。加热条件下硫单质和干燥、纯净的Cl2反应即可生成S2C12,反应的化学方程式为:2S+Cl2 S2Cl2。
S2Cl2。
反应涉及的几种物质的熔沸点如下:
|
物质 |
S |
S2Cl2 |
|
沸点/℃ |
445 |
138 |
|
熔点/℃ |
113 |
-76 |
该小组设计的制备装置如下图(夹持仪器已略去

回答下列问题:
(1)连接好实验装置后的第一步实验操作是______。
(2)实验中需要加热的仪器是______。(填 写 字 母)
(3)装置B、C中的试剂分别是______。
(4)装置D中仪器a的作用是______。
(5)反应结束后从锥形瓶内混合物中分离出产品的方法是____________。
(6)若实验过程中缺少C装置,发现产品浑浊不清,请用化学方程式表示其原因____________
(7)实验完毕,小组中的一位同学把剩余浓盐酸倒入E烧杯中,发现有黄绿色剌激性气 体产生。用离子方程式表示产生该现象的原因____________。



 【查阅资料】① 干燥的氯气在110℃~140℃与硫反应,即可得到S2C12。② S的熔点为112.8℃、沸点为444.6℃;S2C12的熔点为
【查阅资料】① 干燥的氯气在110℃~140℃与硫反应,即可得到S2C12。② S的熔点为112.8℃、沸点为444.6℃;S2C12的熔点为 76℃、沸点为138℃。
76℃、沸点为138℃。 2SCl2。④ S2C12易和水发生反应,生成H2S、SO2、H2SO3、H2SO4等。⑤ClO3-+5Cl-+6H
2SCl2。④ S2C12易和水发生反应,生成H2S、SO2、H2SO3、H2SO4等。⑤ClO3-+5Cl-+6H =3C12↑+3H2O 请回答下列问题:
=3C12↑+3H2O 请回答下列问题: