题目内容
【题目】铁是应用最广泛的金属,铁的卤化物、氧化物、硫酸盐以及高价铁的含氧酸盐均为重要化合物。
(1)在实验室中,FeCl2 可用铁粉和盐酸反应制备,FeCl3可用铁粉和_____反应制备: 现有一含FeCl2和FeCl3的混合物的样品,测得样品中n(Fe):n(Cl) = 1:2.3,则该样品中FeCl3的物质的量分数为____________。
(2)高温下,Fe 与水蒸气反应的化学方程式为____________________。
(3)硫酸亚铁、氯化亚铁溶液存放在实验室均易变质,出现红褐色沉淀,且溶液变棕黄色,则此反应的离子方程式为____________________。
(4)在氯化亚铁溶液中加入等物质的量的过氧化钠,发生反应的总的离子方程式为____________________。
【答案】 Cl2 30% 3Fe+4H2O(g) ![]() Fe3O4+4H2 12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3↓ 4Fe2++4Na2O2+6H2O=8Na++4Fe(OH)3↓+O2↑
Fe3O4+4H2 12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3↓ 4Fe2++4Na2O2+6H2O=8Na++4Fe(OH)3↓+O2↑
【解析】试题分析:本题考查铁元素的单质及其化合物的性质,化学方程式和离子方程式的书写,化学计算。
(1)FeCl3中Fe为+3价,FeCl3可用Fe粉和Cl2反应制备,反应的化学方程式为2Fe+3Cl2![]() 2FeCl3。因为n(Fe):n(Cl)=1:2.3,则[n(FeCl3)+n(FeCl2)]:[3n(FeCl3)+2n(FeCl2)]=1:2.3,n(FeCl3):n(FeCl2)=3:7,样品中FeCl3物质的量分数为
2FeCl3。因为n(Fe):n(Cl)=1:2.3,则[n(FeCl3)+n(FeCl2)]:[3n(FeCl3)+2n(FeCl2)]=1:2.3,n(FeCl3):n(FeCl2)=3:7,样品中FeCl3物质的量分数为![]() 100%=30%。
100%=30%。
(2)高温下铁与水蒸气反应生成Fe3O4和H2,反应的化学方程式为3Fe+4H2O(g)![]() Fe3O4+4H2。
Fe3O4+4H2。
(3)硫酸亚铁、氯化亚铁溶液存放在实验室均易变质,出现红褐色沉淀,溶液变成棕黄色,说明Fe2+被空气中O2氧化成Fe3+和Fe(OH)3,反应可写成Fe2++O2→Fe(OH)3↓+Fe3+,1molFe2+反应失去1mol电子,1molO2反应得到4mol电子,根据得失电子守恒、电荷守恒以及原子守恒,写出离子方程式为12Fe2++3O2+6H2O=4Fe(OH)3↓+8Fe3+。
(4)在氯化亚铁溶液中加入Na2O2,发生的反应有2Na2O2+2H2O=4NaOH+O2↑(①)、FeCl2+2NaOH=Fe(OH)2↓+2NaCl(②)、4Fe(OH)2+O2+2H2O=4Fe(OH)3(③);FeCl2与Na2O2物质的量相等,将①![]() 2+②
2+②![]() 4+③得总反应的化学方程式为4Na2O2+4FeCl2+6H2O=8NaCl+4Fe(OH)3↓+O2↑,总反应的离子方程式为4Na2O2+4Fe2++6H2O=8Na++4Fe(OH)3↓+O2↑。
4+③得总反应的化学方程式为4Na2O2+4FeCl2+6H2O=8NaCl+4Fe(OH)3↓+O2↑,总反应的离子方程式为4Na2O2+4Fe2++6H2O=8Na++4Fe(OH)3↓+O2↑。

 综合自测系列答案
综合自测系列答案【题目】铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验现象有干扰,过多的NO、NO2又会污染环境。改进实验的设计符合绿色化学的思想。某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化。
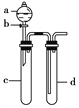
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c。其目的是____________________________________________。
(2)在d中加适量NaOH溶液,c中放一小块铜块,由分液漏斗a向c中加入2 mL浓硝酸,c中反应的化学方程式是___________________________________________。
(3)表中是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是__________,理由是________________________________________________________________________。
方案 | 反应物 |
甲 | Cu、浓硝酸 |
乙 | Cu、稀硝酸 |
丙 | Cu、O2、稀硝酸 |
(4)该兴趣小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2,操作步骤为_______________________,实验现象为________________________________;但此实验的不足之处是___________________________________。



