题目内容
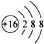
Ⅰ.给出表格是元素周期表的一部分,A、B、C、D、E、X是由表格给出的①~⑦号元素及铁元素组成的常见单质或化合物.
已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)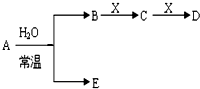
(1)若E为氧化物,则A与水反应的化学方程式为:______.
①当X是碱性盐溶液,C分子中有22个电子时,表示X呈碱性的离子方程式为______.
②当X为金属单质时,则X与B的稀溶液反应生成C的离子反应方程式为:______.
(2)若E为单质气体,D为白色沉淀,A的化学式可能是______.
Ⅱ.如下图所示中各方框表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A、C和D为无色气体,C能使湿润的红色石蕊试纸变蓝,X分解产生A、B和C三种产物的比值为1:1:1.
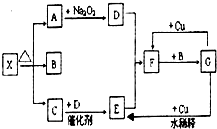
(3)写出下列各物质的化学式X:______;F:______.
(4)按要求写出下列变化的反应化学方程式:
A→D的化学反应方程式:______.
G→E的离子反应方程式:______.
| ① | |||||||||||||||||
| ④ | ⑤ | ⑥ | |||||||||||||||
| ② | ③ | ⑦ | |||||||||||||||
| Fe | |||||||||||||||||

(1)若E为氧化物,则A与水反应的化学方程式为:______.
①当X是碱性盐溶液,C分子中有22个电子时,表示X呈碱性的离子方程式为______.
②当X为金属单质时,则X与B的稀溶液反应生成C的离子反应方程式为:______.
(2)若E为单质气体,D为白色沉淀,A的化学式可能是______.
Ⅱ.如下图所示中各方框表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A、C和D为无色气体,C能使湿润的红色石蕊试纸变蓝,X分解产生A、B和C三种产物的比值为1:1:1.

(3)写出下列各物质的化学式X:______;F:______.
(4)按要求写出下列变化的反应化学方程式:
A→D的化学反应方程式:______.
G→E的离子反应方程式:______.
Ⅰ根据元素在周期表中的位置可判断元素的种类,①为H元素,②为Na元素,③为Al元素,④为C元素,⑤为N元素,⑥为O元素,⑦为Cl元素,
(1)根据表中的元素可知,只有③形成的物质与水反应生成NO气体符合,则A为NO2,A与水反应生成硝酸和一氧化氮,其反应为3NO2+H2O═2HNO3+NO,
①硝酸与碳酸盐反应生成二氧化碳,分子中有6+8×2=22个电子,X为碳酸盐,水解显碱性,水解离子反应为CO32-+H2O?HCO3-+OH-,
②当X为金属时,应为变价金属Fe,X与B的稀溶液反应生成C的离子方程式为Fe+4H++NO3-═Fe3++NO↑+2H2O,
故答案为:3NO2+H2O═2HNO3+NO;CO32-+H2O?HCO3-+OH-;Fe+4H++NO3-═Fe3++NO↑+2H2O;
(2)根据表中的元素可知,只有⑤形成的物质与水反应生成氢气,B为NaOH,D为Al(OH)3,则A可能为Na、Na2O2或NaH,
故答案为:Na、Na2O2或NaH.
Ⅱ.C能使湿润的红色石蕊试纸变蓝,应为NH3,A和过氧化钠反应生成D为气体,且A是无色气体,所以A应为CO2,D为O2,氨气和氧气在催化剂条件下加热生成NO和水,E能和氧气反应,所以E是NO,F为NO2,F和B反应生成G,G和铜反应生成二氧化氮,G为HNO3,B为液体,应为H2O,A、B、C的物质的量之比为1:1:1,则X为NH4HCO3,
(3)由以上分析可知,X为NH4HCO3,F为NO2,故答案为:NH4HCO3;NO2;
(4)A→D为Na2O2和CO2的反应,化学反应方程式:2CO2+2Na2O2=2Na2CO3+O2,G→E为铜和稀硝酸的氧化还原反应的离子反应方程式,离子反应方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:2CO2+2Na2O2=2Na2CO3+O2;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(1)根据表中的元素可知,只有③形成的物质与水反应生成NO气体符合,则A为NO2,A与水反应生成硝酸和一氧化氮,其反应为3NO2+H2O═2HNO3+NO,
①硝酸与碳酸盐反应生成二氧化碳,分子中有6+8×2=22个电子,X为碳酸盐,水解显碱性,水解离子反应为CO32-+H2O?HCO3-+OH-,
②当X为金属时,应为变价金属Fe,X与B的稀溶液反应生成C的离子方程式为Fe+4H++NO3-═Fe3++NO↑+2H2O,
故答案为:3NO2+H2O═2HNO3+NO;CO32-+H2O?HCO3-+OH-;Fe+4H++NO3-═Fe3++NO↑+2H2O;
(2)根据表中的元素可知,只有⑤形成的物质与水反应生成氢气,B为NaOH,D为Al(OH)3,则A可能为Na、Na2O2或NaH,
故答案为:Na、Na2O2或NaH.
Ⅱ.C能使湿润的红色石蕊试纸变蓝,应为NH3,A和过氧化钠反应生成D为气体,且A是无色气体,所以A应为CO2,D为O2,氨气和氧气在催化剂条件下加热生成NO和水,E能和氧气反应,所以E是NO,F为NO2,F和B反应生成G,G和铜反应生成二氧化氮,G为HNO3,B为液体,应为H2O,A、B、C的物质的量之比为1:1:1,则X为NH4HCO3,
(3)由以上分析可知,X为NH4HCO3,F为NO2,故答案为:NH4HCO3;NO2;
(4)A→D为Na2O2和CO2的反应,化学反应方程式:2CO2+2Na2O2=2Na2CO3+O2,G→E为铜和稀硝酸的氧化还原反应的离子反应方程式,离子反应方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:2CO2+2Na2O2=2Na2CO3+O2;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目