题目内容
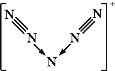
【题目】下列离子方程式正确的是![]()
A.![]() 与少量NaOH溶液的反应:
与少量NaOH溶液的反应:![]()
B.少量![]() 通入NaClO溶液中:
通入NaClO溶液中:![]()
C.用高锰酸钾标准溶液滴定草酸:![]()
D.![]() 和少量
和少量![]() 溶液反应
溶液反应![]()
【答案】B
【解析】
A.Ca(HCO3) 2与少量NaOH溶液反应生成碳酸氢钠、碳酸钙沉淀和水,正确的离子方程式为:Ca2++HCO3—+OH—=CaCO3↓+H2O,故A错误;
B.少量SO2通入NaClO溶液中,发生氧化还原反应,反应的离子方程式为:3ClO—+SO2+H2O=Cl—+SO4 2—+2HClO,故B正确;
C.用高锰酸钾标准溶液滴定草酸,草酸是弱酸需要保留分子式,正确的离子方程式为:2MnO4—+6H++5H2C2O4=2Mn2++10CO2↑+8H2O,故C错误;
D.NH4 HSO4和少量Ba(OH)2溶液反应,氢离子优先, OH—少量不足以和铵根离子反应,正确的离子方程式为:2H++SO42—+Ba 2++2OH—=BaSO4↓+2H2O,故D错误;
答案选B。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
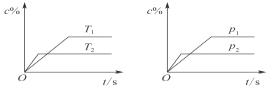
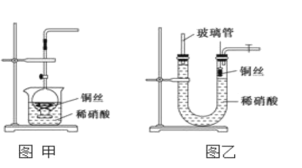
单元加期末复习先锋大考卷系列答案【题目】(1)某学习小组利用下图装置制取氯气并探究其性质。
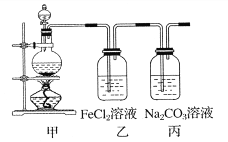
①甲装置中反应的化学方程式是_____________________________________;
②证明乙装置中FeCl2溶液与Cl2发生了反应的实验方法是(只注明试剂、现象)__________________________________________________________;
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是____________________________________。
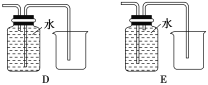
(2)有一瓶长期放置的漂白粉,请利用以下仪器和试剂,完成该漂白粉成份的探究。
试管、胶头滴管、带导管的单孔塞、蒸馏水、1mol·L-1盐酸、品红溶液、新制澄清石灰水。
(提出假设)假设一:该漂白粉未变质,含CaCl2、Ca(ClO)2;
假设二:该漂白粉全部变质,含________________;
假设三:该漂白粉部分变质,含CaCl2、Ca(ClO)2、CaCO3 。
(进行实验)在答题卡上完成下表(不必检验Ca2+、Cl-):
实验步骤 | 预期现象和结论 | |
① | 用A试管取少量澄清石灰水备用,用B试管取少量样品,再向B试管___________________________ | 若无气体放出且澄清石灰水未见浑浊,则假设一成立;______________________________ |
② | __________________________ | ___________________________________________ |