题目内容
三个容积不同的密闭容器中分别充满O2、N2、CH4三种气体,当这些容器内的气体温度和密度均相等时,这三个密闭容器内单位体积所含分子数的相互关系正确的是( )A.n(O2)>n(CH4)>n(N2)
B.n(O2)>n(N2)>n(CH4)
C.n(CH4)>n(N2)>n(O2)
D.n(O2)=n(N2)=n(CH4)
 ,因为温度和密度均相等,所以单位体积的三种气体的质量也相同;由n=
,因为温度和密度均相等,所以单位体积的三种气体的质量也相同;由n= =
=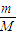 ,相同质量的气体,摩尔质量越大,物质的量越小,所含分子数越小.
,相同质量的气体,摩尔质量越大,物质的量越小,所含分子数越小.解答:解:容器内的气体温度和密度均相等时,单位体积的三种气体的质量也相同,
由n=
 =
=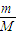 ,相同质量的气体,摩尔质量越大,物质的量越小,所含分子数越小,
,相同质量的气体,摩尔质量越大,物质的量越小,所含分子数越小,因M(O2)>M(N2)>M(CH4),
则这三个密闭容器内单位体积所含分子数的相互关系正确的是n(CH4)>n(N2)>n(O2),
故选C.
点评:本题考查阿伏加德罗定律及其推论,题目难度中等,解答本题注意单位体积这一要求,注意相关计算公式的运用.

(16分)工业上可以在恒容密闭容器中采用下列反应制备甲醇:
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(1)下列情况可以作为判断反应达到平衡状态的依据的是(填序号) 。
A.生成CH3OH 的速率与消耗H2的速率之比为1︰2
B.混合气体的平均相对分子质量保持不变
C.混合气体的密度保持不变
D.体系内的压强保持不变
(2)下表所列数据为该反应在不同温度下的化学平衡常数:
|
温度/℃ |
250 |
300 |
350 |
|
K |
2.041 |
0.270 |
0.012 |
①反应的平衡常数表达式为K= 。由上表数据判断,该反应的△H 0(填“>”、“=”或“<”)。升高温度,正反应速率 (填“增大”、“减小”或“不变”)。
②某温度下,将2molCO和6molH2充入一个容积为2L的密闭容器中,达到平衡时c(H2)=1.4mol/L,则CO的转化率为 ,此时的温度为 。
(3)欲提高CO的转化率,可采取的措施是 。(填序号)
A.升温
B.加入更高效的催化剂
C.恒容条件下充入CO
D.恒容条件下充入H2
E.恒容条件下充入氦气
F.及时移走CH3OH
(4)一定条件下,CO和H2在催化剂作用下生成1molCH3OH的能量变化为90.8kJ。该温度下,在三个容积相同的密闭容器中,按不同方式投料,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
|
容器 |
甲 |
乙 |
丙 |
|
|
投料方式 |
1molCO、 2molH2 |
1molCH3OH |
2molCH3OH |
|
|
平衡数据 |
C(CH3OH)/(mol/L) |
c1 |
c2 |
c3 |
|
体系压强(Pa) |
p1 |
p2 |
p3 |
|
|
反应的能量变化 |
akJ |
bkJ |
ckJ |
|
|
原料转化率 |
α1 |
α2 |
α3 |
下列分析正确的是 。(填序号)
A.2c1 <c3 B.2 p1 <p3 C.|a|+|b|=90.8 D.α1+α3>1
 2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。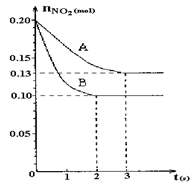
 2NO2
2NO2
 2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。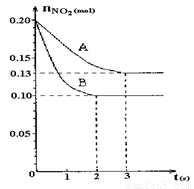
 2NO2
2NO2