题目内容
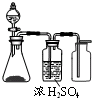 实验室利用下列各组物质制备并收集相应气体时,能采用下图实验装置的是( )
实验室利用下列各组物质制备并收集相应气体时,能采用下图实验装置的是( )| A、电石与水 | B、浓硝酸与铜片 | C、生石灰与浓氨水 | D、过氧化氢溶液与MnO2 |
分析:根据装置图可以看出,在不加热的条件下制备气体,在常温下进行,生成气体可用浓硫酸干燥,气体可用向上排空法收集,以此来解答题目.
解答:解:A.电石和水反应生成乙炔,具有还原性,不能用浓硫酸干燥,故A错误;
B.铜屑和浓硝酸在常温下可反应,生成二氧化氮气体可用浓硫酸干燥,密度比空气大,用向上排空法收集,故B正确;
C.生石灰与浓氨水生成氨气,氨气不能用浓硫酸干燥,故C错误;
D.过氧化氢溶液与MnO2生成氧气,密度比空气大,可用向上排空气法收集,故D正确;
故选BD.
B.铜屑和浓硝酸在常温下可反应,生成二氧化氮气体可用浓硫酸干燥,密度比空气大,用向上排空法收集,故B正确;
C.生石灰与浓氨水生成氨气,氨气不能用浓硫酸干燥,故C错误;
D.过氧化氢溶液与MnO2生成氧气,密度比空气大,可用向上排空气法收集,故D正确;
故选BD.
点评:本题考查常见气体的制备、干燥和收集,做题时要充分考虑物质的性质,认真分析实验装置图的特点是解题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
