题目内容
19.向甲溶液中缓慢滴加乙溶液,反应生成沉淀的质量与乙溶液的量之间的关系如图所示,其中符合图象的是( )| 甲 | 乙 | 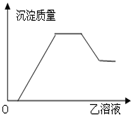 | |
| A | AlCl3、Mg(NO3)2、HNO3 | NaOH | |
| B | Na2CO3、NH4HCO3、Na2SO4 | Ba(OH)2 | |
| C | NH4NO3、Al(NO3)3、Fe(NO3)3、HCl | NaOH | |
| D | NaAlO2、氨水、NaOH | H2SO4 |
| A. | A | B. | B | C. | C | D. | D |
分析 由图象可知,先加入乙溶液时,没有沉淀生成,随着乙的增加,沉淀的质量逐渐增大,当沉淀增大到最大值时,沉淀质量不变,继续加入乙,沉淀质量逐渐减少,但沉淀不能完全溶解,结合对应物质的性质解答该题.
解答 解:A.甲:AlCl3、Mg(NO3)2、HNO3;乙:NaOH:将氢氧化钠加入AlCl3、Mg(NO3)2、HNO3的过程中,图象中间一段沉淀不变的反应不存在,与图象变化不相符,故A错误;
B.Ba(OH)2将加入Na2CO3、NH4HCO3、Na2SO4溶液中,不存在沉淀部分溶解的反应,与图象变化不相符,故B错误;
C.第一段是与盐酸反应,第二段与Al(NO3)3、Fe(NO3)3产生2种沉淀,第三段与NH4NO3反应,第四段是溶解氢氧化铝,符合图象曲线的变化,故C正确;
D.将H2SO4加入NaAlO2、氨水、NaOH的混合液中,最终沉淀会全部溶解,与图象变化不相符,故D错误;
故选C.
点评 本题考查离子反应及其综合应用,题目难度中等,明确常见离子的性质为解答关键,注意金属及其化合物是重要的无机物,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
9.下列有关实验的叙述正确的是( )
| A. | 用水润湿的pH试纸来测量溶液的pH | |
| B. | 实验需要480mL 2.0mol•L-1的氢氧化钠溶液.配制该溶液时先称量氢氧化钠固体38.4g,然后再按照溶解、冷却、移液、洗涤、定容、摇匀的步骤进行操作 | |
| C. | 向溶液中滴加硝酸酸化的Ba(NO3)2溶液出现白色沉淀,说明溶液中一定有SO42- | |
| D. | 用溴水,淀粉、KI溶液比较Br2与I2的氧化性强弱,所需玻璃仪器主要有:试管、胶头滴管 |
14.25℃时,水的电离达到平衡:H2O?H++OH-;△H>0,下列叙述正确的是( )
| A. | 向水中加入少量固体NaHSO4,c(H+)增大,KW不变 | |
| B. | 向水中加入少量NaOH溶液,平衡逆向移动,c(OH-)减小 | |
| C. | 向水中加入少量冰醋酸,平衡正向移动,c(H+) 增大 | |
| D. | 将水加热,KW增大,pH不变 |
4.电镀等工业废水中常含有剧毒、致癌的Cr2O72-.该废水处理的一种方法是:利用还原剂把Cr2O72-还原成毒性较低的Cr3+,再加碱生成沉淀.另一种方法是:向废水中加入适当的NaCl,用Fe作电极进行电解.下列说法错误的是( )
| A. | 电解时,阳极反应为:Fe-2e-=Fe2+ | |
| B. | 电解过程中阴极能产生氢气 | |
| C. | 电解过程中,Cr2O72-在阳极放电 | |
| D. | 电解过程中,溶液中生成Cr(OH)3和Fe(OH)3沉淀 |
11.1L 1mol•L-1 Na2SO4溶液中,下列各量正确的是( )
| A. | c(Na+)=1mol•L-1 | B. | n(Na+)=3mol | C. | c(SO42-)=2mol•L-1 | D. | m(Na2SO4)=142g |
9.下列实验操作或事实与预期实验目的或所得结论对应正确的是( )
| A. | 淡黄色试液$\stackrel{NaOH溶液}{→}$红褐色沉淀 说明原溶液中一定含有FeCl3 | |
| B. | H3PO3+2NaOH(足量)=Na2HPO3+2H2O,H3PO3属于三元酸 | |
| C. | 新收集的酸雨$\stackrel{Ba(NO_{3})_{2}溶液}{→}$白色沉淀酸雨中一定含有SO42- | |
| D. | CaO$\stackrel{H_2{O}}{→}$Ca(OH)2$\stackrel{Na_{2}CO_{3}}{→}$NaOH 用生石灰制备NaOH溶液 |