��Ŀ����
����Ŀ������粒㷺Ӧ���빤ũ�����У�����������ͼ���£��ش��������⣺
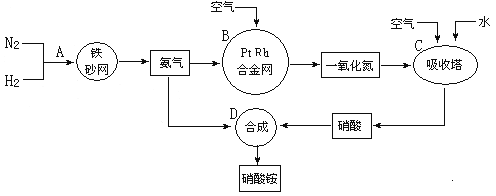
��1����������ҵ������������У�B�豸�������� ���ڷ�Ӧ�е����������� ��
��2�������������У�N2��H2�ϳ�NH3���õĴ����� ���ںϳɰ����豸(�ϳ���)�У������Ƚ�������Ŀ���� ���ںϳ��������������ͨ�������Ŀ���� ��
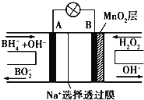
��3����ѧ����(NH3)Ϊȼ�Ͽ������͵�ȼ�ϵ������������ɴ���O2�����ӵ� MnO3�������ʣ�����ܷ�ӦΪ��4NH3+3O2=2N2+6H2O�������ĵ缫��ӦʽΪ ��
��4��ij���ʳ���NH3�Ʊ�NH4NO3����֪����NH3��NO�IJ�����96%��NO��HNO3�IJ�����92%������HNO3����ȥ��NH3������Լռ�ܺ�NH3����(�������������)�� %��(ȡ��λ��Ч����)
��5���������һ�ֳ��õĵ��ʣ���ʹ�øû���ʱ��������Է���һ��ʹ�ã������� ��
���𰸡�
��1������¯��NO��
��2������ý���������ȣ���Լ��Դ�� ��ʹNOȫ��ת����HNO3
��3��2NH3+3O2�� - 6e��= N2+ 3H2O
��4��53% ��
��5��NH4+ˮ������ԣ�����ϴٽ���ˮ����
��������
�����������1��B�а���������������һ����������װ������Ϊ����¯(��������)����Ӧ�Ļ�ѧ����ʽΪ��4NH3+5O2![]() 4NO+6H2O����Ӧ������������NO���ʴ�Ϊ������¯(��������)��NO��
4NO+6H2O����Ӧ������������NO���ʴ�Ϊ������¯(��������)��NO��
��2��N2��H2�ϳ�NH3���õĴ���Ϊ����ý���ϳɰ��ķ�Ӧ���ڷ��ȷ�Ӧ����Ӧ�����л�ų��������ȣ����Ƚ��������Գ���������ȣ���Լ��Դ�����������ж���������ˮ��Ӧ���������NO��ͨ�������NO�ܱ������е���������Ϊ����������������������ˮ��Ӧ�������ᣬ����ʹNOѭ�����ã�ȫ��ת��Ϊ����ʴ�Ϊ������ý���������ȣ���Լ��Դ����ʹNOѭ�����ã�ȫ��ת����HNO3��
��3����������ɴ���O2�����ӵ� MnO3�������ʣ�����ܷ�ӦΪ��4NH3+3O2=2N2+6H2O����������������Ӧ���缫��ӦʽΪ2NH3+3O2�� - 6e��= N2+ 3H2O���ʴ�Ϊ��2NH3+3O2�� - 6e��= N2+ 3H2O��
��4�����ݵ�ԭ���غ��֪��NH3��NO��HNO3����1mol�����ɵõ���������ʵ���Ϊ��1mol��96%��92%=0.8832mol������HNO3+NH3�TNH4NO3��֪��Ӧ���ĵİ��������ʵ���Ϊ��0.8832mol������������֮�ȵ������ʵ���֮��������HNO3����ȥ��NH3������ռ�ܺ�NH3�����İٷ���Ϊ��![]() ��100%��53%���ʴ�Ϊ��53%��
��100%��53%���ʴ�Ϊ��53%��
��5��������е�NH4+ˮ������ԣ�����ϴٽ���ˮ�⣻ʹ��ʱӦ��������Է���һ��ʹ�ã��ʴ�Ϊ��NH4+ˮ������ԣ�����ϴٽ���ˮ�⡣