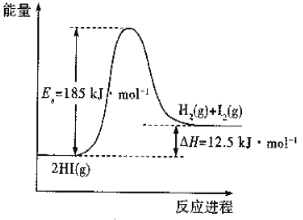
题目内容
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:
(1)KIO3的化学名称是_________________。
(2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示:
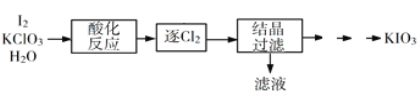
“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是______________________。
“滤液”中的溶质主要是__________________。
(3)KIO3也可采用“电解法”制备,装置如图所示。
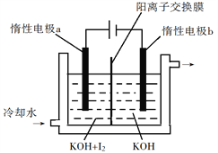
①写出电解时阴极的电极反应式________________________________。
②电解过程中通过阳离子交换膜的离子主要为_______________。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有___________________________________________(写出一点)。
【答案】碘酸钾加热KCl2H2O + 2e- = 2OH-+H2↑K+产生Cl2易污染环境(或其它合理作案)
【解析】
(1)KIO3的化学名称是碘酸钾;
(2)气体在加热的过程中在水中的溶解度降低,可采取此法驱逐气体,实验流程是用KClO3氧化法制备KIO3,反应物是KClO3和I2,在酸性条件下ClO3-可以氧化I2生成IO3-,根据已知条件,还原产物含有Cl2和Cl-,驱逐Cl2后结晶产物应为KCl,相当于是除杂步骤;
(3)①电解池阴极为KOH溶液,电解质溶液呈碱性,电解池阴极发生还原反应,过程应为H2O转化为H2;
②隔膜是阳离子交换膜,起主要交换的离子应为K+,电解池工作时,阳离子向阴极移动;
③电解法过程中,阳极发生反应I2-10e-+12OH-═2IO3-+6H2O制备KIO3,整个电解池装置没有产生氧化法过程中的Cl2,即没有产生污染大气环境的有毒气体。
(1)KIO3的化学名称是碘酸钾;
(2)气体在加热的过程中在水中的溶解度降低,可采取此法驱逐气体,所以逐Cl2”采用的方法是:加热,根据已知条件,还原产物含有Cl2和Cl-,驱逐Cl2后结晶产物应为KCl;
(3)①电解池阴极为KOH溶液,电解质溶液呈碱性,电解池阴极发生还原反应,过程应为H2O转化为H2,阴极的电极反应为:2H2O+2e-═2OH-+H2↑;
②隔膜是阳离子交换膜,只允许阳离子通过。由于电解质中的阳离子主要为钾离子,故通过交换膜的离子主要为K+;
③电解法过程中,阳极发生反应I2-10e-+12OH-═2IO3-+6H2O制备KIO3,电解池装置产生的气体是H2,氧化法过程则产生Cl2,Cl2是有毒气体会污染大气,因此氧化法的不足之处是产生Cl2易污染环境。

 阅读快车系列答案
阅读快车系列答案