��Ŀ����
��һ���¶��£���2 mol SO2��1 mol O2ͨ��һ���ݻ����ܱ�������������·�Ӧ��2SO2+O2����д���пհף�
(1)��a=0��b=0,��c=______________ mol��
(2)��a=0.5 mol����b=______________ mol��c=______________ mol��
(3)a��b��cȡֵ���������һ��������(������������ʽ��ʾ������һ��ֻ��a��c����һ��ֻ��b��c)____________________________��
������2SO2+O2![]() 2SO3��һ����Ӧǰ��������������ȵĿ��淴Ӧ�����ڶ��¡���������2 mol SO2��1 mol O2��0 mol SO3�������˻�ѧƽ��״̬����Ҫ��ͬ�¡�ͬ�����ݻ��̶�,n(SO2)Ϊa mol��n(O2)Ϊb mol��n(SO3)Ϊc mol�������£���������������ͬ�Ļ�ѧƽ��״̬��Ҳ�����������ֲ�ͬ������ܽ�������ͬ�Ļ�ѧƽ��״̬��
2SO3��һ����Ӧǰ��������������ȵĿ��淴Ӧ�����ڶ��¡���������2 mol SO2��1 mol O2��0 mol SO3�������˻�ѧƽ��״̬����Ҫ��ͬ�¡�ͬ�����ݻ��̶�,n(SO2)Ϊa mol��n(O2)Ϊb mol��n(SO3)Ϊc mol�������£���������������ͬ�Ļ�ѧƽ��״̬��Ҳ�����������ֲ�ͬ������ܽ�������ͬ�Ļ�ѧƽ��״̬��
��2SO2+O2![]() 2SO3
2SO3
2 mol 1 mol 0
��2SO2+O2![]() 2SO3
2SO3
0 0 2 mol
��2SO2+O2![]() 2SO3(a��b=2��1)
2SO3(a��b=2��1)
a b c
��2SO2+O2 ![]() 2SO3
2SO3
(a+c) (b+![]() ) 0
) 0
��2SO2+O2![]() 2SO3
2SO3
0 0 (c+a)��(c+2b)
(a��b=2��1)
�ɢڢ�֪��a=0��b=0��c=2���ɢ٢�֪��a+c=2��b+![]() =1��a=0.5��c=1.5��b=0.25��
=1��a=0.5��c=1.5��b=0.25��
�𰸣�(1)2
(2)0.25 1.5
(3)a+c=2��b+c=1

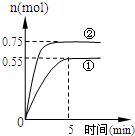 ̼ѭ����;��֮һ�ǣ�CO2��g��+3H2��g��?CH3OH��g��+H2O��g��+49.0kJ�����ݻ�Ϊ2L���ܱ������г���1mol CO2��3mol H2�������ֲ�ͬ��ʵ�������½��з�Ӧ�����CH3OH��g�������ʵ�����ʱ��仯�������ͼ��ʾ��
̼ѭ����;��֮һ�ǣ�CO2��g��+3H2��g��?CH3OH��g��+H2O��g��+49.0kJ�����ݻ�Ϊ2L���ܱ������г���1mol CO2��3mol H2�������ֲ�ͬ��ʵ�������½��з�Ӧ�����CH3OH��g�������ʵ�����ʱ��仯�������ͼ��ʾ��