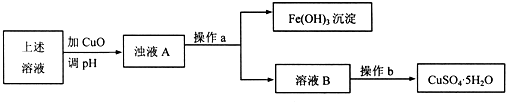
题目内容
黄铜矿CuFeS2可用于冶炼铜,冶炼过程中需要空气和硅石,硅石主要用于形成炉渣,其反应的总方程式为:
2CuFeS2+2SiO2+5O2=2Cu+2FeSiO3+4SO2.
请回答下列问题:
(1)若CuFeS2中Cu的化合价为+2,则反应中被还原的元素是______(填元素符号).
(2)黄铜矿冶炼铜产生的炉渣中主要含Fe2O3、FeSiO3、SiO2、Al2O3等,请完成以下验证炉渣中含有+2价的铁的探究过程中的有关问题:
仅限选择的试剂有:
稀盐酸、稀硫酸、稀硝酸、NaOH溶液、KMnO4溶液、KSCN溶液.
①应选用试剂为______.
②有关的实验现象为______.
(3)最近我国发现,以黄铜矿为原料在沸腾炉中和空气反应,生成物冷却后经溶解、除铁、结晶得到CuSO4?5H2O,生产成本降低了许多.实验结果如下表:
| 沸腾炉温度/℃ | 560 | 580 | 600 | 620 | 640 | 660 |
| 生成物中含水溶性铜化合物的百分含量/% | 90.12 | 91.24 | 93.50 | 92.38 | 89.96 | 84.23 |
| 生成物中含酸溶性铜化合物的百分含量/% | 92.00 | 93.60 | 97.08 | 97.82 | 98.16 | 98.19 |
②温度高于600℃生成物中水溶性铜化合物百分含量下降的原因是______.
(4)另据报道,有一种叫Thibacillus ferroxidans的细菌,在酸性溶液中利用氧气可以将黄铜矿氧化成硫酸盐,试写出该反应的化学方程式:______.
解:(1)若CuFeS2中Cu的化合价为+2,则Fe为+2价,S为-2价,反应中Cu和O元素化合价降低,被还原,故答案为:Cu、O;
(2)①验证炉渣中含有+2价的铁,应先加入稀硫酸溶解,生成亚铁离子,具有还原性,可与高锰酸钾发生氧化还原反应,酸化时不能加入盐酸,否则与高锰酸钾发生氧化还原反应,也不能直接加入硝酸,否则生成铁离子,不能检验,
故答案为:稀硫酸、KMnO4溶液;
②稀硫酸浸取炉渣所得溶液含有亚铁离子,与高锰酸钾发生氧化还原反应而使高锰酸钾褪色,
故答案为:稀硫酸浸取炉渣所得溶液能使KMnO4溶液褪色;
(3)①CuFeS2与O2反应放热,可通过控制加入CuFeS2的速度调节温度,
故答案为:控制加入CuFeS2的速度(原因:CuFeS2与O2反应放热);
②水溶性铜化合物为CuSO4?5H2O,酸溶性铜化合物为CuO,温度较高时,CuSO4?5H2O可分解生成CuO,则在600℃以上时水溶性铜化合物含量减少,
故答案为:生成的CuSO4发生了分解生成酸溶性铜化合物;
(4)在酸性溶液中利用氧气可以将黄铜矿氧化成硫酸盐,则应有硫酸参加反应,且生成硫酸铜,硫酸铁和水,
反应的方程式为4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O,
故答案为:4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O.
分析:(1)若CuFeS2中Cu的化合价为+2,则Fe为+2价,S为-2价,反应中Cu和O元素化合价降低,S元素化合价升高;
(2)验证炉渣中含有+2价的铁,应先加入稀硫酸溶解,生成亚铁离子,具有还原性,可与高锰酸钾发生氧化还原反应;
(3)水溶性铜化合物为CuSO4?5H2O,酸溶性铜化合物为CuO,温度较高时,CuSO4?5H2O可分解生成CuO,CuFeS2与O2反应放热,可通过控制加入CuFeS2的速度调节温度;
(4)根据反应物和生成物结合质量守恒定律书写反应的化学方程式.
点评:本题考查考查较为综合,涉及物质的制备、检验和性质实验设计等问题,侧重于考查学生综合运用化学知识的能力,为高考常见题型,难度中等.
(2)①验证炉渣中含有+2价的铁,应先加入稀硫酸溶解,生成亚铁离子,具有还原性,可与高锰酸钾发生氧化还原反应,酸化时不能加入盐酸,否则与高锰酸钾发生氧化还原反应,也不能直接加入硝酸,否则生成铁离子,不能检验,
故答案为:稀硫酸、KMnO4溶液;
②稀硫酸浸取炉渣所得溶液含有亚铁离子,与高锰酸钾发生氧化还原反应而使高锰酸钾褪色,
故答案为:稀硫酸浸取炉渣所得溶液能使KMnO4溶液褪色;
(3)①CuFeS2与O2反应放热,可通过控制加入CuFeS2的速度调节温度,
故答案为:控制加入CuFeS2的速度(原因:CuFeS2与O2反应放热);
②水溶性铜化合物为CuSO4?5H2O,酸溶性铜化合物为CuO,温度较高时,CuSO4?5H2O可分解生成CuO,则在600℃以上时水溶性铜化合物含量减少,
故答案为:生成的CuSO4发生了分解生成酸溶性铜化合物;
(4)在酸性溶液中利用氧气可以将黄铜矿氧化成硫酸盐,则应有硫酸参加反应,且生成硫酸铜,硫酸铁和水,
反应的方程式为4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O,
故答案为:4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O.
分析:(1)若CuFeS2中Cu的化合价为+2,则Fe为+2价,S为-2价,反应中Cu和O元素化合价降低,S元素化合价升高;
(2)验证炉渣中含有+2价的铁,应先加入稀硫酸溶解,生成亚铁离子,具有还原性,可与高锰酸钾发生氧化还原反应;
(3)水溶性铜化合物为CuSO4?5H2O,酸溶性铜化合物为CuO,温度较高时,CuSO4?5H2O可分解生成CuO,CuFeS2与O2反应放热,可通过控制加入CuFeS2的速度调节温度;
(4)根据反应物和生成物结合质量守恒定律书写反应的化学方程式.
点评:本题考查考查较为综合,涉及物质的制备、检验和性质实验设计等问题,侧重于考查学生综合运用化学知识的能力,为高考常见题型,难度中等.

练习册系列答案
相关题目