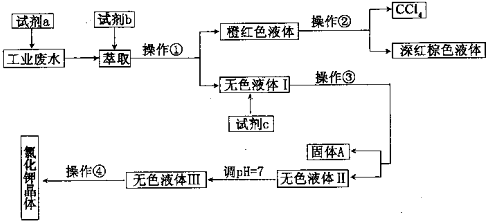
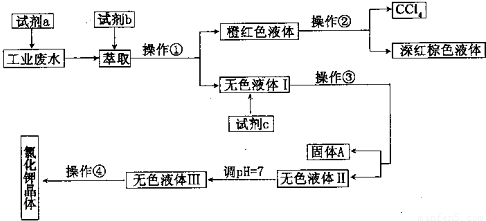
题目内容
某厂废液中含有大量Ag+、Fe3+、Al3+,用下列图示方法进行分离(部分反应条件省略).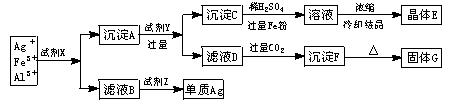
(1)写出下列物质的化学式:
试剂X_______. 试剂Z_______.
晶体E_______. 固体G_______.
(2)写出下列反应的离子方程式:
沉淀A+试剂Y:___________________.
滤液D+过量CO2:__________________.
答案:
解析:
解析:
| 设计意图:本题融生活常识、信息、离子方程式的书写、原子结构等知识于一体来考查学生综合运用所学知识的能力及其对基础知识掌握得牢固程度.
解析:(1)根据生活常识可知,我国在食盐中添加的含碘化合物为碘酸钾(KIO3);KIO3具有氧化性,在酸性环境中可氧化I-为I2,而I2可用淀粉溶液来检验,若溶液变蓝,说明有I2存在.其反应的离子方程式为:IO (2)根据质量数=质子数+中子数,可知每个 易错点:主要是基础知识不过关或粗心而出现错误.如不能根据日常所学或题中信息判断出KIO3和KI反应的产物(能用淀粉检验的物质只能是I2单质),写化学方程式时不注意酸性条件而写错或把化学方程式写成离子方程式;把食盐中的添加剂KIO3用名称表示而未用化学式等. 答案:(1)KIO3;KIO3+5KI+3H2SO4===3I2+3K2SO4+3H2O;混合液与食盐相遇时,呈蓝色 (2)72
|

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
 人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉.
人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉.Ⅰ.废液组成:
| 金属元素 | Ni | Mn | Co | Fe | Cu | Zn |
| 浓度(g?L-1) | 45 | 15 | 7.5 | ≤0.1 | ≤0.05 | ≤0.05 |
步骤1:调节pH:向强酸性溶液中加入NaOH溶液调节pH到2.
此步骤中工业上不直接使用饱和Na2CO3溶液来调节溶液的pH的原因可能是
步骤2:除去Mn2+、Co2+离子:在搅拌下加入适量饱和Na2CO3溶液和NaClO溶液并控制pH≤3.5,过滤.
①Mn2+反应生成MnO2同时放出CO2,写出此反应的离子方程式:
②Co2+反应生成Co(OH)3沉淀同时放出CO2,写出此反应的离子方程式:
Ni2+可反应生成Ni(OH)3沉淀,Co2+可使Ni(OH)3转化为Co(OH)3沉淀,写出Ni(OH)3转化为Co(OH)3的离子方程式:
③此步骤中必须控制好NaClO溶液的用量,其原因可能是
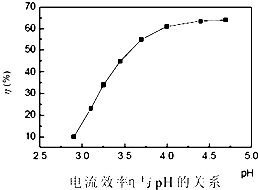
步骤3:回收镍以铅片为阳极,镍铬钛不锈钢片为阴极,电解步骤2中所得滤液,在阴极得到镍粉.电解过程中电流效率与pH的关系如图,分析图表,回答下列问题:
①pH较低时,电流效率低的原因可能是:
②电解的最佳pH范围是:
A.3.0~3.5 B.3.5~4.0 C.4.0~4.5 D.4.5~5.0.