题目内容
在实验室里制取的乙烯中常混有少量的二氧化硫,某化学兴趣小组设计了如图所示的实验装置以确认上述混合气体中是否含有SO2和C2H4.请回答下列问题:
(1)Ⅰ、II、Ⅲ、Ⅳ装置可盛放的试剂是:(请将下列有关试剂的序号填入对应装置内,可重复选用).A.品红溶液B.NaOH溶液C.浓硫酸D.溴水
I______;Ⅱ______;Ⅲ______;IV______;
(2)能说明SO2气体存在的现象是______;
(3)使用装置Ⅱ的目的是______;
(4)确定含有乙烯的现象是______;
(5)写出装置Ⅳ发生的化学反应______;反应类型______;
(6)为了制备重要的有机原料--氯乙烷(CH3-CH2Cl),下面是两位同学设计的方案.
甲同学:选乙烷和适量氯气在光照条件下制备,原理是:CH3-CH3+Cl2
CH3-CH2Cl+HCl
乙同学:选乙烯和适量氯化氢在一定条件下制备,原理是:CH2=CH2+HCl→CH3-CH2Cl
你认为上述两位同学的方案中,合理的是______,简述你的理由:______.
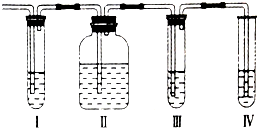
(1)Ⅰ、II、Ⅲ、Ⅳ装置可盛放的试剂是:(请将下列有关试剂的序号填入对应装置内,可重复选用).A.品红溶液B.NaOH溶液C.浓硫酸D.溴水
I______;Ⅱ______;Ⅲ______;IV______;
(2)能说明SO2气体存在的现象是______;
(3)使用装置Ⅱ的目的是______;
(4)确定含有乙烯的现象是______;
(5)写出装置Ⅳ发生的化学反应______;反应类型______;
(6)为了制备重要的有机原料--氯乙烷(CH3-CH2Cl),下面是两位同学设计的方案.
甲同学:选乙烷和适量氯气在光照条件下制备,原理是:CH3-CH3+Cl2
| 光照 |
乙同学:选乙烯和适量氯化氢在一定条件下制备,原理是:CH2=CH2+HCl→CH3-CH2Cl
你认为上述两位同学的方案中,合理的是______,简述你的理由:______.

(1)检验二氧化硫用品红溶液,检验乙烯用高锰酸钾酸性溶液,乙烯和二氧化硫都能使高锰酸钾酸性溶液褪色,所以先检验二氧化硫,然后检验乙烯,同在检验乙烯之前用NaOH溶液除尽SO2,再通过品红溶液不褪色确认SO2已除干净,最后用高锰酸钾酸性溶液褪色检验乙烯;
因装置I用来检验SO2,试管中品红溶液褪色,说明含有SO2,装置II试管装有NaOH溶液除去SO2,装置III试管通过品红溶液不褪色确认SO2已除干净,装置IV 通过高锰酸钾酸性溶液褪色检验乙烯,
故答案为:A;B;A;D;
(2)装置I用来检验是否存在SO2,试管中品红溶液褪色,说明含有SO2,故答案为:Ⅰ中品红溶液褪色;
(3)氢氧化钠溶液能够与二氧化硫反应,所以装置Ⅱ试管装有NaOH溶液除去SO2,故答案为:除去二氧化硫;
(4)装置Ⅳ通过溴水褪色检验乙烯,故答案为:Ⅲ中品红溶液不褪色,IV中溴水褪色;
(5)乙烯能与溴水发生加成反应生成二溴乙烷:CH2=CH2+Br-Br→CH2Br-CH2Br,故答案为:CH2=CH2+Br-Br→CH2Br-CH2Br;加成反应;
(6)烷烃的取代反应是分步进行的,反应很难停留在某一步,所以得到的产物往往是混合物;乙烯与HCl反应只有一种加成产物,故答案为:乙同学的方案;由于烷烃的取代反应是分步进行的,反应很难停留在某一步,所以得到的产物往往是混合物;而用乙烯与HCl反应只有一种加成产物,所以可以得到相对纯净的产物.
因装置I用来检验SO2,试管中品红溶液褪色,说明含有SO2,装置II试管装有NaOH溶液除去SO2,装置III试管通过品红溶液不褪色确认SO2已除干净,装置IV 通过高锰酸钾酸性溶液褪色检验乙烯,
故答案为:A;B;A;D;
(2)装置I用来检验是否存在SO2,试管中品红溶液褪色,说明含有SO2,故答案为:Ⅰ中品红溶液褪色;
(3)氢氧化钠溶液能够与二氧化硫反应,所以装置Ⅱ试管装有NaOH溶液除去SO2,故答案为:除去二氧化硫;
(4)装置Ⅳ通过溴水褪色检验乙烯,故答案为:Ⅲ中品红溶液不褪色,IV中溴水褪色;
(5)乙烯能与溴水发生加成反应生成二溴乙烷:CH2=CH2+Br-Br→CH2Br-CH2Br,故答案为:CH2=CH2+Br-Br→CH2Br-CH2Br;加成反应;
(6)烷烃的取代反应是分步进行的,反应很难停留在某一步,所以得到的产物往往是混合物;乙烯与HCl反应只有一种加成产物,故答案为:乙同学的方案;由于烷烃的取代反应是分步进行的,反应很难停留在某一步,所以得到的产物往往是混合物;而用乙烯与HCl反应只有一种加成产物,所以可以得到相对纯净的产物.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
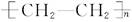 分子组成的化合物,加热至某一温度则可完全熔化
分子组成的化合物,加热至某一温度则可完全熔化
 D
D