题目内容
【题目】水污染的防治、环境污染的治理是化学工作者研究的重要课题,也是践行“绿水青山就是金山银山”的重要举措。在适当的条件下,将CO2转化为甲醚:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH ,既可降低CO2造成的温室效应对环境的影响,还可得到重要的有机产物。
CH3OCH3(g)+3H2O(g) ΔH ,既可降低CO2造成的温室效应对环境的影响,还可得到重要的有机产物。
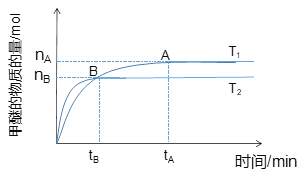
(1)在容积为2 L密闭容器中合成甲醇;其他条件不变的情况下,考察温度对反应的影响,如图所示
①该反应的ΔH________0;ΔS______0(填“>”、“<”或“=”)。
②下列措施可增加甲醚产率的是_____________。
A.升高温度 B.将CH3OCH3(g)从体系中分离
C.使用合适的催化剂 D.充入He,使体系总压强增大
③温度为T1时,从反应开始到平衡,生成甲醚的平均速率为___________________。
(2)一定条件下,向某恒容密闭容器中充入x mol CO2和y mol H2合成甲醚
①下图1中能表示该反应的平衡常数K与温度T之间的变化关系曲线为______(填“a”或“b”)。
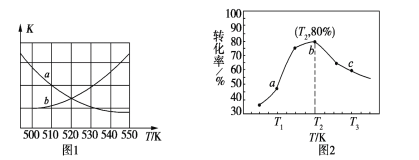
②若x=2、y=3,测得在相同时间内不同温度下H2的转化率如图2所示,则在该时间段内,恰好达到化学平衡时,容器内的压强与反应开始时的压强之比为___________。
【答案】< < B ![]() mol·L-1·min-1 a 17︰25
mol·L-1·min-1 a 17︰25
【解析】
(1)根据反应图像可知,tB<tA,反应达到平衡时间越短,反应速率越快,对应温度越高,则T2>T1,由T1到T2,升高温度,甲醚的物质的量减少,平衡逆向移动,则ΔH<0;根据反应中气体的分子变化可知,ΔS<0;
②A.升高温度,平衡逆向移动,甲醚的产率降低,A错误;
B.将CH3OCH3(g)从体系中分离,体系中甲醚的浓度减小,平衡正向移动,产率增大,B正确;
C.使用合适的催化剂,对化学平衡无影响,产率不变,C错误;
D.充入He,使体系总压强增大,容积为恒容密闭容器,各反应量不变,平衡不移动,产率不变,D错误;
③v=![]() /
/![]() ;
;
(2) ①氢气与二氧化碳合成甲醚的焓变小于0,升高温度平衡逆向移动,则化学平衡常数减小;
②冲入反应物时升高温度,反应正向进行,当温度变为T2时,达到平衡状态,则氢气的转化率为80%,即反应2.4mol;容器内的压强与反应开始时的压强之比等于平衡时气体与开始时气体的物质的量之比;
(1)根据反应图像可知,tB<tA,反应达到平衡时间越短,反应速率越快,对应温度越高,则T2>T1,由T1到T2,升高温度,甲醚的物质的量减少,平衡逆向移动,则ΔH<0;根据反应的化学方程式可知反应后气体分子数减少,故ΔS<0;
②A.升高温度,平衡逆向移动,甲醚的产率降低,A错误;
B.将CH3OCH3(g)从体系中分离,体系中甲醚的浓度减小,平衡正向移动,产率增大,B正确;
C.使用合适的催化剂,对化学平衡无影响,产率不变,C错误;
D.充入He,使体系总压强增大,容积为恒容密闭容器,各反应量不变,平衡不移动,产率不变,D错误;
答案为B
③根据图像可知,甲醚的物质的量为nAmol,反应时间为tA,容积为2L,v=nA/(2tA)mol/(L![]() min);
min);
(2) ①氢气与二氧化碳合成甲醚的焓变小于0,升高温度平衡逆向移动,则化学平衡常数减小,图像中的曲线a符合;
②冲入反应物时升高温度,反应正向进行,当温度变为T2时,达到平衡状态,则氢气的转化率为80%,即反应2.4mol;

容器内的压强与反应开始时的压强之比等于平衡时气体与开始时气体的物质的量之比=3.4:5=17:25;

【题目】利用图中所示装置进行实验,不能得出相应现象的是( )
选项 | 溶液① | 固体② | 溶液③ | 实验现象 |
|
A | 浓氨水 | 碱石灰 | 酚酞试液 | 酚酞试液变红 | |
B | 浓盐酸 |
|
| 产生淡黄色沉淀 | |
C | 浓硝酸 |
|
| 试管上方产生红棕色气体 | |
D | 稀硫酸 |
|
| 产生白色沉淀 |
A.AB.BC.CD.D