题目内容
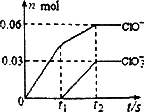
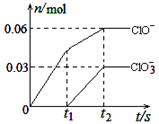
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。

下列说法正确的是
- A.苛性钾溶液中KOH的质量是4.94 g
- B.反应中转移电子的物质的量是0.09 mol
- C.氧化性ClO-<ClO
- D.ClO的生成是由于温度升高引起的
D
Cl2通入一定浓度的苛性钾溶液中生成了ClO-和ClO两种离子,CL元素的化合价升高,即还要生成CL—,根据氧化还原反应过程中得失电子数相等可得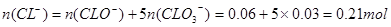 ,根据电荷守恒,得
,根据电荷守恒,得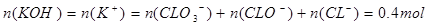 ,A错,
,A错,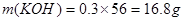 ;B错,反应中转移电子的物质的量是0.21mol;C错,氧化性ClO-<ClO;D正确;
;B错,反应中转移电子的物质的量是0.21mol;C错,氧化性ClO-<ClO;D正确;
Cl2通入一定浓度的苛性钾溶液中生成了ClO-和ClO两种离子,CL元素的化合价升高,即还要生成CL—,根据氧化还原反应过程中得失电子数相等可得
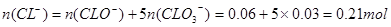 ,根据电荷守恒,得
,根据电荷守恒,得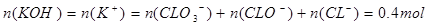 ,A错,
,A错,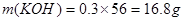 ;B错,反应中转移电子的物质的量是0.21mol;C错,氧化性ClO-<ClO;D正确;
;B错,反应中转移电子的物质的量是0.21mol;C错,氧化性ClO-<ClO;D正确; 
练习册系列答案
相关题目
 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如右图所示.下列说法正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如右图所示.下列说法正确的是( )| A、苛性钾溶液中KOH的质量是4.94g | B、反应中转移电子的物质的量是0.21mol | C、氧化性ClO-<ClO3- | D、ClO3-的生成是由于温度升高引起的 |
 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法正确的是( )