题目内容
13.依据反应原理:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl,并利用下列装置制取碳酸氢钠粗品,实验装置正确且能达到实验目的是( )| A. | 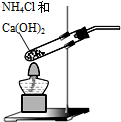 用装置制取氨气 | B. |  用装置制取二氧化碳 | ||
| C. |  用装置制取碳酸氢钠 | D. |  用装置分离碳酸氢钠与母液 |
分析 A.加热固体制取气体时,试管口要低于试管底;
B.稀硫酸和碳酸钙反应生成的硫酸钙属于微溶物,阻止进一步反应;
C.氨气极易溶于水,为防止倒吸要有缓冲装置;
D.过滤时需要用玻璃棒引流.
解答 解:A.加热固体制取气体时,试管口要低于试管底,否则生成的水蒸气冷凝会倒流而炸裂试管,故A错误;
B.稀硫酸和碳酸钙反应生成的硫酸钙属于微溶物,阻止进一步反应,应该用稀盐酸和碳酸钙制取二氧化碳,故B错误;
C.氨气极易溶于水,为防止倒吸要有缓冲装置,通入氨气的装置有缓冲作用,能防止倒吸,故C正确;
D.过滤时需要用玻璃棒引流,否则易溅出液体且易导致滤纸损坏,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及实验基本操作,明确实验原理及操作规范性是解本题关键,注意从操作规范性分析评价,易错选项是B.

练习册系列答案
相关题目
1.已知在溶液中HCO3-一般不发生电离,即以HCO3-的形式存在.下列电离方程式书写正确的是( )
| A. | H2SO4=H22++SO42- | B. | NaHCO3=Na++H++CO32- | ||
| C. | NaOH=Na++O2-+H+ | D. | Na3PO4=3Na++PO43- |
18.下列有关氯气及其含氯分散系的说法正确的是( )
| A. | 钢铁在Cl2气氛中主要发生电化腐蚀 | |
| B. | 在新制氯水中加入少量CaCO3,溶液中c(HClO)增大 | |
| C. | 反应3Cl2(g)+8NH3(g)=6NH4Cl(s)+N2(g)的△H>0,△S<0 | |
| D. | 0.1mol•L-1NaClO溶液中:c(HClO)+c(H+)=c(OH-) |
2.某混合物的水溶液,只可能含有以下离子中的若干:NH4+、Cl-、Mg2+、Ba2+、K+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加足量NaOH溶液加热后,收集到气体0.04mol;
③第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥,沉淀质量2.33g.
根据上述实验,以下推测正确的是( )
①第一份加入AgNO3溶液有沉淀产生;
②第二份加足量NaOH溶液加热后,收集到气体0.04mol;
③第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥,沉淀质量2.33g.
根据上述实验,以下推测正确的是( )
| A. | K+一定不存在 | |
| B. | 该溶液中含CO32-离子的浓度为0.1 mol/L | |
| C. | Cl-可能存在 | |
| D. | Ba2+一定不存在,Mg2+可能存在 |
 .
.