题目内容
制备金属氯化物时,常采用两种方法:①用金属单质和氯气直接化合制得;②用金属单质和盐酸反应制得.下列氯化物中用以上两种方法都可以制得的是( )
分析:A、Cu与稀盐酸不反应;
B、Fe与稀盐酸反应生成FeCl2;
C、Fe与Cl2直接化合生成FeCl3;
D、Al与Cl2或与盐酸反应都直接生成AlCl3.
B、Fe与稀盐酸反应生成FeCl2;
C、Fe与Cl2直接化合生成FeCl3;
D、Al与Cl2或与盐酸反应都直接生成AlCl3.
解答:解:A、Cu和氯气直接化合制得CuCl2,但Cu与稀盐酸不反应,不符合题意,故A错误;
B、Fe和氯气直接化合制得FeCl3,但Fe与稀盐酸反应生成FeCl2,不符合题意,故B错误;
C、Fe和氯气直接化合制得FeCl3,但Fe与稀盐酸反应生成FeCl2,不符合题意,故C错误;
D、Al和氯气直接化合制得AlCl3,且Al与盐酸反应制得AlCl3,符合题意,故D正确;
故选D.
B、Fe和氯气直接化合制得FeCl3,但Fe与稀盐酸反应生成FeCl2,不符合题意,故B错误;
C、Fe和氯气直接化合制得FeCl3,但Fe与稀盐酸反应生成FeCl2,不符合题意,故C错误;
D、Al和氯气直接化合制得AlCl3,且Al与盐酸反应制得AlCl3,符合题意,故D正确;
故选D.
点评:本题考查物质的制备,明确铁、氯气、盐酸的性质及发生的化学反应是解答本题的关键,难度不大.

练习册系列答案
相关题目
镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取
镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)以MgCl2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有 。
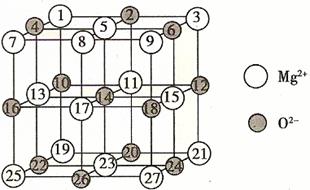
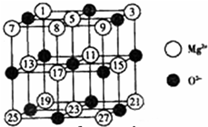
(2)已知MgO的晶体结构属于NaCl型。某同学画出的MgO晶胞结构示意图如下图所示,请改正图中错误: 。
(3)用镁粉、碱金属盐及碱土金属盐等可以做成焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因: 。
(4)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:![]()
![]()
![]()
![]()
![]()
![]()
![]()
| 氧化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
解释表中氟化物熔点差异的原因: 。
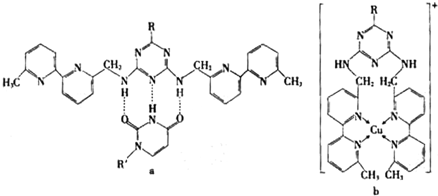
(5)人工模拟是当前研究的热点。有研究表明,化合物X可用于研究模拟酶,当其结合 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b:

①a中连接相邻含N杂环的碳碳键可以旋转,说明该碳碳键具有 键的特性。
②微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相互作用力的差异 。
 (2008?广东)镁、铜等金属离子是人体内多种酶的辅因子.工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁.
(2008?广东)镁、铜等金属离子是人体内多种酶的辅因子.工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁.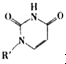 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b: