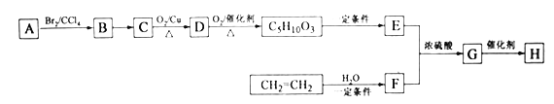
题目内容
【题目】X、Y、Z、R、W均为元素周期表中前四周期的元素,其原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质。回答下列问题(相关问题均用元素符号或化学式表示):
(1)R的基态原子的核外电子排布式是_____________________。
(2)Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低的原因是_______________。
(3)X与Z中电负性较大的是_________;Z的某种含氧酸盐常用于实验室中X单质的制取,此酸根离子的空间构型是__________,此离子中含有的化学键类型是__________;X—Z—X的键角______109°28'(填“>”“<”或“=”)
(4)X与Y形成的化合物Y2X的晶胞如图。其中X离子的配位数为_______,以距离一个X离子最近的所有Y离子为顶点构成的几何体为________。该化合物与MgO相比,熔点较高的是____________。

(5)已知该化合物的晶胞边长为a pm,则该化合物的密度为_________g/cm3。(列算式,不必计算出数值,阿伏伽德罗常数的数值为NA)
【答案】[Ar]3d54s1HF分子间形成氢键,HCl分子间不存在氢键O三角锥形共价键<8正方体MgO
【解析】
X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;X2-和Y+有相同的核外电子排布,则X在Y上一周期,且X位于第VIA族、Y位于第IA族;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低,则Z氢化物中不含氢键,其上一周期同一主族元素氢化物有氢键;R的基态原子在前四周期元素的基态原子中单电子数最多,则R为Cr元素;X位于第二周期,为O元素;Y、Z位于第三周期,Y为Na元素;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质,实验室用浓盐酸和二氧化锰制取氯气,所以W为Mn元素,Z为Cl元素。
根据上述分析,X为O元素、Y为Na元素、Z为Cl元素、R为Cr元素、W为Mn元素。
(1)R为Cr元素,其原子核外有24个电子,根据构造原理书写R的基态原子的核外电子排布式为[Ar]3d54s1,故答案为:[Ar]3d54s1;
(2)Z为Cl元素,氢化物的熔沸点与相对分子质量成正比,但含有氢键的氢化物熔沸点较高,HCl中不含氢键而HF中含有氢键,所以HF熔沸点高于HCl,故答案为:HF分子间存在氢键、HCl分子间不存在氢键;
(3)X是O、Z是Cl,X与Z中电负性较大的是O;
Z的某种含氧酸盐常用于实验室中X的单质的制取,实验室用氯酸钾制取氧气,ClO3-中中心原子价层电子对个数=3+![]() =4且含有一个孤电子对,根据价层电子对互斥理论判断此酸根离子的空间构型为三角锥形;此离子中含有的化学键类型是共价键;孤电子对和成键电子对之间的排斥力大于成键电子对之间的排斥力,所以其键角小于109°28′,故答案为:O;三角锥形;共价键;<;
=4且含有一个孤电子对,根据价层电子对互斥理论判断此酸根离子的空间构型为三角锥形;此离子中含有的化学键类型是共价键;孤电子对和成键电子对之间的排斥力大于成键电子对之间的排斥力,所以其键角小于109°28′,故答案为:O;三角锥形;共价键;<;
(4)O与Na形成的化合物Na2O,根据晶胞结构可知,黑球为钠离子(Y),白球为氧离子(X),则该晶胞中氧离子的配位数为8;以距离一个氧离子最近的所有钠离子为顶点构成的几何体为正方体;离子化合物中,化合物的熔沸点与晶格能成正比,晶格能与离子半径成反比、与电荷成正比,钠离子半径大于镁离子,而电荷小于镁离子,所以氧化钠熔沸点低于MgO,故答案为:8;正方体;MgO;
(5)该化合物的晶胞边长为apm,其体积=(a×10-10 cm )3,该晶胞中钠离子个数为8、氧离子个数=8×![]() +6×
+6×![]() =4,则该化合物的密度为
=4,则该化合物的密度为![]() =
= gcm-3,故答案为:
gcm-3,故答案为: 。
。

【题目】在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应:A(g) B(g)+C(g)
ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强p/100 kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为________________________。
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为________,平衡时A的转化率为________,列式并计算反应的平衡常数K_______________________________。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n总=________mol,n(A)=________mol。
②下表为反应物A浓度与反应时间的数据,计算:a=________。
反应时间t/h | 0 | 4 | 8 | 16 |
c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.006 5 |
分析该反应中反应物的浓度c(A)变化与时间间隔(Δt)的规律,得出的结论是______________________________________,由此规律推出反应在12 h时反应物的浓度c(A)为________mol·L-1。