题目内容
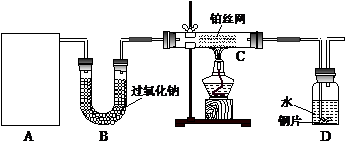
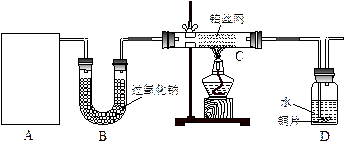
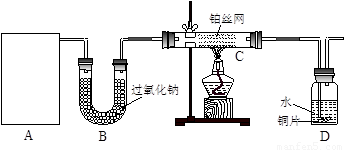
某化学课外活动小组在实验室用废铁屑或废铁丝与稀硫酸在加热条件下制取FeSO4·xH2O晶体,并测定该晶体中结晶水含量。?请回答下列问题:?
(1)铁屑表面少量的铁锈(主要成分为Fe2O3·aH2O)对制取硫酸亚铁有无影响 (填“有”或“无”)。其原因是: 。如有影响将如何操作? (若无影响,此问可以不答)。
(2)FeSO4在不同温度下的溶解度如下表所示:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
溶解度/g | 18.5 | 20.8 | 26.3 | 32.8 | 40.1 | 48.4 | 52.4 | 50.9 | 43.7 |
由于废铁屑含有C、Si等杂质,为了使FeSO4溶液的浓度增大,便于反应后分离溶液和残渣,该小组实验时采取了水浴加热和趁热过滤的方法。这样做的主要目的是为了防止 。你认为实验时的水浴温度最好控制在 ℃?左右。??
(3)测定晶体中结晶水含量所用的实验仪器除托盘天平(或物理天平)、研钵、坩埚、坩埚钳、三脚架、泥三角、酒精灯、药匙外,还有 ;判断晶体中结晶水完全失去的实验操作是 。?
(4)计算硫酸亚铁晶体化学式中x的实验值表达式为x= ?。(已知:硫酸亚铁晶体中结晶水的质量为m g、硫酸亚铁晶体的质量为w g)?
(5)由于铁屑或铁丝与硫酸反应速率慢,实验过程中有的同学提出采用电解的方法,可以加快制取FeSO4溶液的反应速率,该方法的电解质溶液是 ,阳极的电极反应方程式为: 。?
请你再写出一种(不包括改变温度和硫酸的浓度)以铁单质为反应物,能加快制取FeSO4溶液反应速率的方法: 。?
(1)无Fe2O3·xH2O与H2SO4反应生成Fe3+,过量的铁屑可以将Fe3+?还原成Fe2+,只要保证铁屑过量,就可以排除铁锈的影响 ???
(2)析出硫酸亚铁晶体与残渣一起被过滤掉(或硫酸亚铁晶体析出)60
(3)玻璃棒、干燥器连续两次加热、冷却、称量的质量差不超过0.1 g
(4)x =![]() ?
?
(5)稀硫酸 阳极:Fe - 2e- = Fe2+??
增大反应物接触面积:用铁粉与稀硫酸反应;利用原电池原理:用铁与铜(或CuSO4溶液,C粉等)和稀硫酸反应?
增加阳离子的氧化性:用过量的铁粉与CuSO4溶液或Fe2(SO4)3溶液等反应(3分,其他合理答案参照给分)?
解析:(1)无影响,因铁锈Fe2O3·aH2O + 6H += 2Fe3++(a+3)H2O,2Fe3++ Fe=3Fe2+?,只要Fe量大即无影响。?
(2)FeSO4的溶解度在60 ℃较大,故可在60 ℃过滤,防止低温下析出的FeSO4和C、Si等杂质一并过滤掉。?
(3)将FeSO4·xH2O 在坩埚中加热后应在干燥器中冷却以防止再结合水,故缺玻璃棒(搅拌用)和干燥器。是否完全失水的判断方法是连续两次加热、冷却、称量,其质量差不超过0.1 g。?
(4)FeSO4·xH2O= FeSO4 + xH2O?
152+18x 18x?
w m?
x =![]() ??
??
(5)要使Fe转化为Fe2+?,故Fe必作阳极,电解溶液为H2SO4。?
(6)可利用Fe作原电池负极的方法加快反应。?
如加入CuSO4溶液、或加入单质铜、或加入碳粉等。