题目内容
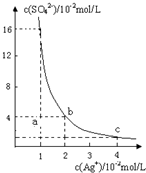 某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示:
某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示:(1)a点表示Ag2SO4
不饱和
不饱和
(填“饱和”或“不饱和”) 溶液;(2)b点对应的Ksp
=
=
d点对应的Ksp(填“<”、“>”或“=”);(3)现将足量的Ag2SO4分别放入:
a.40mL 0.01mol?L-1 K2SO4溶液,b.10mL蒸馏水;
c.10mL 0.02mol?L-1H2SO4溶液;
则Ag2SO4的溶解度由大到小的排列顺序为
b>a>c
b>a>c
(填字母)(4)下列有关Ag2SO4说法正确的是
BC
BC
A.含有大量SO42-的溶液中肯定不存在Ag+
B.Ag2SO4的溶度积常数(Ksp)为1.6×10-5 (mol?L-1)3
C.0.02mol?L-1的AgNO3溶液与0.2mol?L-1的Na2SO4溶液等体积混合不会生成沉淀
(5)往Ag2SO4溶液中加入足量的Na2CrO4固体,可观察到砖红色沉淀(Ag2CrO4为砖红色),写出沉淀转化的离子方程式
Ag2SO4+CrO42-?Ag2CrO4+SO42-
Ag2SO4+CrO42-?Ag2CrO4+SO42-
.分析:(1)Ag2SO4在水中沉淀溶解平衡为:Ag2SO4(s)?2Ag+(aq)+SO42-(aq),ksp=c2(Ag+)×c(SO42-),处于曲线上的点为饱和状态,随着SO42-浓度的增大,Ag+浓度减小;
(2)b、d两点处于曲线上的点为饱和状态,溶液中存在溶解沉淀平衡,溶度积常数随温度变化,不随浓度变化;
依据图象分析一定温度下的溶度积Ksp=c2(Ag+)×c(SO42-)=(2×10-2)2×4×10-2=1.6×10-5(mol?L-1)3;(3)依据图象分析一定温度下的溶度积Ksp=c2(Ag+)×c(SO42-)=(2×10-2)2×4×10-2=1.6×10-5(mol?L-1)3;结合溶液中银离子浓度计算分析判断;
(4)A、依据硫酸银存在沉淀溶解平衡分析;
B、溶度积是温度的函数,只随温度变化;
C、依据溶液中银离子浓度和硫酸根离子浓度,运用溶度积计算方法计算,和Ksp比较判断;
(5)依据沉淀转化的原理和离子方程式的书写方法写出,符合原子守恒,电荷守恒.
(2)b、d两点处于曲线上的点为饱和状态,溶液中存在溶解沉淀平衡,溶度积常数随温度变化,不随浓度变化;
依据图象分析一定温度下的溶度积Ksp=c2(Ag+)×c(SO42-)=(2×10-2)2×4×10-2=1.6×10-5(mol?L-1)3;(3)依据图象分析一定温度下的溶度积Ksp=c2(Ag+)×c(SO42-)=(2×10-2)2×4×10-2=1.6×10-5(mol?L-1)3;结合溶液中银离子浓度计算分析判断;
(4)A、依据硫酸银存在沉淀溶解平衡分析;
B、溶度积是温度的函数,只随温度变化;
C、依据溶液中银离子浓度和硫酸根离子浓度,运用溶度积计算方法计算,和Ksp比较判断;
(5)依据沉淀转化的原理和离子方程式的书写方法写出,符合原子守恒,电荷守恒.
解答:解:(1)依据图象分析一定温度下的溶度积Ksp=c2(Ag+)×c(SO42-)=(2×10-2)2×4×10-2=1.6×10-5(mol?L-1)3;图象中a点处的离子浓度为:c(SO42-)=1×10-2mol/L,c(Ag+)=2×10-2mol/L,c2(Ag+)×c(SO42-)=4×10-6<ksp,不是饱和溶液;故答案为:不饱和;
(2)b、d两点处于曲线上的点为饱和状态,溶液中存在溶解沉淀平衡,溶度积常数随温度变化,不随浓度变化;Ksp不变,故答案为:=;
(3)一定温度下的溶度积Ksp=c2(Ag+)×c(SO42-)=(2×10-2)2×4×10-2=1.6×10-5(mol?L-1)3;将足量的Ag2SO4分别放入:a.40mL0.01mol?L-1 K2SO4溶液,0.01mol/L的硫酸根抑制硫酸银的溶解沉淀平衡;b.10mL蒸馏水中形成饱和溶液;c.10mL0.02mol?L-1H2SO4溶液中,0.02mol/L的硫酸根离子抑制沉淀溶解平衡;则Ag2SO4的溶解度由大到小的排列顺序为:b>a>c;故答案为:b>a>c;
(4)A、硫酸银溶液中存在沉淀溶解平衡,银离子存在,故A错误;
B、依据图象分析一定温度下的溶度积Ksp=c2(Ag+)×c(SO42-)=(2×10-2)2×4×10-2=1.6×10-5(mol?L-1)3;故B正确;
C、0.02mol?L-1的AgNO3溶液与0.2mol?L-1的Na2SO4溶液等体积混合,溶液中C(Ag+)=0.01mol/L;C(SO42-)=0.1mol/L;c2(Ag+)×c(SO42-)=10-5<ksp,不是饱和溶液,无沉淀生成,故C正确;
故答案为:BC;
(5)往Ag2SO4溶液中加入足量的Na2CrO4固体,可观察到砖红色沉淀(Ag2CrO4为砖红色),说明Ag2CrO4溶解性小于Ag2SO4发生了沉淀转化,反应的离子方程式为:Ag2SO4+CrO42-?Ag2CrO4+SO42-;故答案为:Ag2SO4+CrO42-?Ag2CrO4+SO42-.
(2)b、d两点处于曲线上的点为饱和状态,溶液中存在溶解沉淀平衡,溶度积常数随温度变化,不随浓度变化;Ksp不变,故答案为:=;
(3)一定温度下的溶度积Ksp=c2(Ag+)×c(SO42-)=(2×10-2)2×4×10-2=1.6×10-5(mol?L-1)3;将足量的Ag2SO4分别放入:a.40mL0.01mol?L-1 K2SO4溶液,0.01mol/L的硫酸根抑制硫酸银的溶解沉淀平衡;b.10mL蒸馏水中形成饱和溶液;c.10mL0.02mol?L-1H2SO4溶液中,0.02mol/L的硫酸根离子抑制沉淀溶解平衡;则Ag2SO4的溶解度由大到小的排列顺序为:b>a>c;故答案为:b>a>c;
(4)A、硫酸银溶液中存在沉淀溶解平衡,银离子存在,故A错误;
B、依据图象分析一定温度下的溶度积Ksp=c2(Ag+)×c(SO42-)=(2×10-2)2×4×10-2=1.6×10-5(mol?L-1)3;故B正确;
C、0.02mol?L-1的AgNO3溶液与0.2mol?L-1的Na2SO4溶液等体积混合,溶液中C(Ag+)=0.01mol/L;C(SO42-)=0.1mol/L;c2(Ag+)×c(SO42-)=10-5<ksp,不是饱和溶液,无沉淀生成,故C正确;
故答案为:BC;
(5)往Ag2SO4溶液中加入足量的Na2CrO4固体,可观察到砖红色沉淀(Ag2CrO4为砖红色),说明Ag2CrO4溶解性小于Ag2SO4发生了沉淀转化,反应的离子方程式为:Ag2SO4+CrO42-?Ag2CrO4+SO42-;故答案为:Ag2SO4+CrO42-?Ag2CrO4+SO42-.
点评:本题考查了沉淀溶解平衡的概念应用,溶度积的分析判断,沉淀转化的原理,关键是难溶物存在的溶解沉淀平衡的判断,溶度积只随温度变化,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
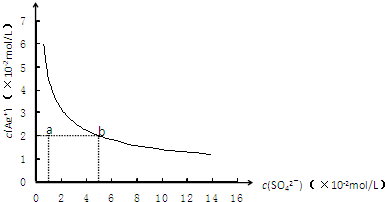
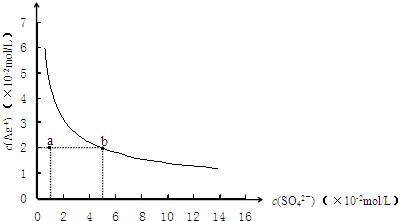

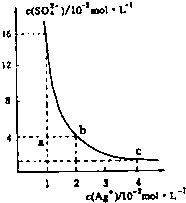 某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示,下列说法中不正确的是( )
某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示,下列说法中不正确的是( )