题目内容
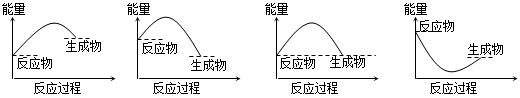
(10分) (1)下图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2
和CO反应的热化学方程式:_____________________________________。

(2)我国实施“嫦娥探月”行动的长征火箭中使用偏二甲肼[(CH3)2N—NH2]作为燃料,其与过氧化氢发生反应放出大量热量C2H8N2(l)+8H2O2(l)===N2(g)+2CO2(g)+12H2O(g) ΔH=-2 500 kJ/mol。如果1 mol偏二甲肼与过氧化氢发生上述反应生成液态水,则反应中放出的热量Q______2 500 kJ(填“<”、“>”或“=”)。
(3)恒温恒容下,2 mol H2与2 mol N2反应达到平衡时,N2为1.8 mol,H2的转化率为________;若该反应在恒温恒压条件下进行(其他条件相同),反应达平衡时,H2的转化率比上述条件下H2的转化率________(填“大”、“小”或“相等”)。
(4)由甲烷、氧气和KOH溶液组成的新型燃料电池中,正极上发生反应的电极反应式为________________。
和CO反应的热化学方程式:_____________________________________。

(2)我国实施“嫦娥探月”行动的长征火箭中使用偏二甲肼[(CH3)2N—NH2]作为燃料,其与过氧化氢发生反应放出大量热量C2H8N2(l)+8H2O2(l)===N2(g)+2CO2(g)+12H2O(g) ΔH=-2 500 kJ/mol。如果1 mol偏二甲肼与过氧化氢发生上述反应生成液态水,则反应中放出的热量Q______2 500 kJ(填“<”、“>”或“=”)。
(3)恒温恒容下,2 mol H2与2 mol N2反应达到平衡时,N2为1.8 mol,H2的转化率为________;若该反应在恒温恒压条件下进行(其他条件相同),反应达平衡时,H2的转化率比上述条件下H2的转化率________(填“大”、“小”或“相等”)。
(4)由甲烷、氧气和KOH溶液组成的新型燃料电池中,正极上发生反应的电极反应式为________________。
(1)NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=-234 kJ/mol (3分)
(2)>
(3)30% 大
(4)O2+2H2O+4e-===4OH-
(2)>
(3)30% 大
(4)O2+2H2O+4e-===4OH-
(1)根据图像可知,反应物的总能量高于生成物的总能量,所以反应是放热反应,反应热是134kJ/mo-l368kJ/mol=-234kJ/mol,所以热化学方程式是NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=-234 kJ/mol。
(2)由于气态水的能量高于液态水的能量,所以偏二甲肼燃烧生成液态水放出的能量多,即Q大于2500kJ。
(3)N2为1.8 mol,则消耗氮气是0.2mol,所以消耗氢气是0.6mol,因此氢气的转化率是0.6÷2=0.3,即转化率是30%。由于合成氨的反应是体积减小的可逆反应,所以压强也是减小的,因此在恒温恒压条件下进行时,有利于平衡向正反应方向进行,即氢气的转化率增大。
(4)原电池中负极失去电子,正极得到电子,因此氧气在正极通入。由于电解质时氢氧化钾,所以正极反应式是O2+2H2O+4e-===4OH-。
(2)由于气态水的能量高于液态水的能量,所以偏二甲肼燃烧生成液态水放出的能量多,即Q大于2500kJ。
(3)N2为1.8 mol,则消耗氮气是0.2mol,所以消耗氢气是0.6mol,因此氢气的转化率是0.6÷2=0.3,即转化率是30%。由于合成氨的反应是体积减小的可逆反应,所以压强也是减小的,因此在恒温恒压条件下进行时,有利于平衡向正反应方向进行,即氢气的转化率增大。
(4)原电池中负极失去电子,正极得到电子,因此氧气在正极通入。由于电解质时氢氧化钾,所以正极反应式是O2+2H2O+4e-===4OH-。

练习册系列答案
相关题目