题目内容
Ⅰ.若X为金属元素,Y为非金属元素,Y2H4是一种重要有机化工原料.
(1)写出Y2H4的一种用途:
(2)X单质与Fe2O3反应时,每消耗13.5g X放热213kJ,该反应的热化学方程式是
| ||
| ||
Ⅱ.若X、Y元素的最高价氧化物的水化物都是强酸.
(3)为防止YO2污染空气,科学家寻求合适的化合物G和催化剂,以实现反应:YO2+G
| 催化剂 |
①上述反应式中的G不可能是
A.NH3 B.CO C.CH3CH2OH D.H2O2
②用稀土材料GeO2作催化剂,能提高YO2的转化速率.煅烧Ge(OH)CO3可制备GeO2,配平该反应的化学方程式:
Ⅰ.若X为金属元素,Y为非金属元素,Y2H4是一种重要有机化工原料,则为乙烯,所以Y是碳元素,X与Y相邻周期、相邻主族,且X是金属,所以X是Al元素;
Ⅱ.若X、Y元素的最高价氧化物的水化物都是强酸,则X和Y都是非金属元素,X、Y是相邻周期、相邻主族,且原子序数X>Y,第二周期其最高价氧化物的水化物是强酸的是N元素,所以Y是N元素,X是S元素.
Ⅰ.若X为金属元素,Y为非金属元素,Y2H4是一种重要有机化工原料,则为乙烯,所以Y是碳元素,X与Y相邻周期、相邻主族,且X是金属,所以X是Al元素;
Ⅱ.若X、Y元素的最高价氧化物的水化物都是强酸,则X和Y都是非金属元素,X、Y是相邻周期、相邻主族,且原子序数X>Y,第二周期其最高价氧化物的水化物是强酸的是N元素,所以Y是N元素,X是S元素.
(1)乙烯在合成材料方面,大量用于生产聚乙烯、氯乙烯及聚氯乙烯,可作为植物生长调节剂,故答案为:植物生长调节剂;
(2)Al单质与Fe2O3反应时,每消耗13.5g Al放热213kJ,即每消耗
| 13.5 |
| 27 |
2Al+Fe2O3
| ||
故答案为:2Al+Fe2O3
| ||
(3)①YO2是二氧化氮,二氧化氮和G反应生成氮气,则二氧化氮作氧化剂,所以G作还原剂,必须具有还原性,且G中必须含有H元素,所以G不可能是CO,故选B;
②Ge(OH)CO3→GeO2,失去一个电子,O2→2O2-,得到4个电子,所以得失电子最小公倍数是4,则Ge(OH)CO3的计量数是4,O2的计量数是1,然后根据原子守恒平衡,所以该反应方程式为4Ge(OH)CO3+1O2═4GeO2+4CO2+2H2O,
故答案为:4;1;4;4;2.

 名校课堂系列答案
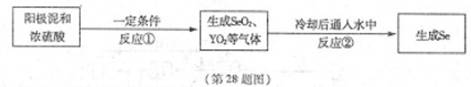
名校课堂系列答案X、Y为两种主族元素,原子序数X小于Y,它们与元素Se三种元素原子序数之和为56。已知:X有两种氧化物M和N。Y与Se是相邻周期同主族元素,其中Se可以从电解精炼铜的阳极泥中获得。从阳极泥中提取Se的流程如下:

回答下列问题:(各元素用相应的元素符号表示)
⑴写出X和Y形成的化合物的电子式 。
⑵阳极泥中Se以单质、Ag2Se、Cu2Se等形式存在。写出①中Se单质与浓硫酸反
应的化学方程式
⑶写出反应②的化学方程式为 。
⑷某温度下在容积固定的密闭容器中,下列反应达到平衡:
M(g)+H2O(g) N(g)+H2(g)
N(g)+H2(g)
|
n(M):n(H2O) |
M转化率 |
H2O转化率 |
|
1:1 |
0.5 |
0.5 |
|
1:2 |
0.67 |
0.335 |
|
1:3 |
0.75 |
0.25 |
①已知M和H2的燃烧热分别为283kJ/mol、285.8kJ/mol,H2O(g)=H2O(l)△H=
—44kJ/mol,写出上述反应的热化学方程式 。
②该反应的平衡常数为 。该温度下,向容器中充入1molM、3mol H2O、
2mol N、1.5molH2,则起始时该反应速率V正 V逆(填“>”、“<”或“=”)
③结合表中数据判断下列说法中正确的是
A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
D.当M与H2O(g)物质的之比为1:4时,M的转化率为0.85
X、Y为两种主族元素,原子序数X小于Y,它们与元素Se三种元素原子序数之和为56。已知:X有两种氧化物M和N。Y与Se是相邻周期同主族元素,其中Se可以从电解精炼铜的阳极泥中获得。从阳极泥中提取Se的流程如下:
回答下列问题:(各元素用相应的元素符号表示)
(1)写出X和Y形成的化合物的电子式 。
(2)阳极泥中Se以单质、Ag2Se、Cu2Se等形式存在。写出①中Se单质与浓硫酸反应的化学方程式 。
(3)写出反应②的化学方程式为 。
(4)某温度下在容积固定的密闭容器中,下列反应达到平衡:M(g)+H2O(g)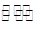 N(g)+H2(g)
N(g)+H2(g)
|
n(M):n(H2O) |
M转化率 |
H2O转化率 |
|
1:1 |
0.5 |
0.5 |
|
1:2 |
0.67 |
0.335 |
|
1:3 |
0.75 |
0.25 |
①已知M和H2的燃烧热分别为283kJ/mol、285.8kJ/mol,H2O(g)=H2O(l)△H=—44kJ/mol,
写出上述反应的热化学方程式 。
②该反应的平衡常数为 。该温度下,向容器中充入1molM、3mol H2O、2mol N、1.5molH2,则起始时该反应速率V正 V逆(填“>”、“<”或“=”)
③结合表中数据判断下列说法中正确的是
A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
D.当M与H2O(g)物质的之比为1:4时,M的转化率为0.85
X、Y为两种主族元素,原子序数X小于Y,它们与元素Se三种元素原子序数之和为56。已知:X有两种氧化物M和N。Y与Se是相邻周期同主族元素,其中Se可以从电解精炼铜的阳极泥中获得。从阳极泥中提取Se的流程如下:
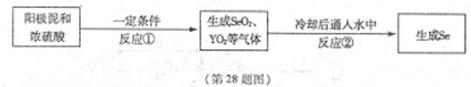
回答下列问题:(各元素用相应的元素符号表示)
(1)写出X和Y形成的化合物的电子式 。
(2)阳极泥中Se以单质、Ag2Se、Cu2Se等形式存在。写出①中Se单质与浓硫酸反应的化学方程式 。
(3)写出反应②的化学方程式为 。
(4)某温度下在容积固定的密闭容器中,下列反应达到平衡:M(g)+H2O(g)![]() N(g)+H2(g)
N(g)+H2(g)
| n(M):n(H2O) | M转化率 | H2O转化率 |
| 1:1 | 0.5 | 0.5 |
| 1:2 | 0.67 | 0.335 |
| 1:3 | 0.75 | 0.25 |
①已知M和H2的燃烧热分别为283kJ/mol、285.8kJ/mol,H2O(g)=H2O(l)△H=—44kJ/mol,
写出上述反应的热化学方程式 。
②该反应的平衡常数为 。该温度下,向容器中充入1molM、3mol H2O、2mol N、1.5molH2,则起始时该反应速率V正 V逆(填“>”、“<”或“=”)
③结合表中数据判断下列说法中正确的是
A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
D.当M与H2O(g)物质的之比为1:4时,M的转化率为0.85
X、Y为两种主族元素,原子序数X小于Y,它们与元素Se三种元素原子序数之和为56。已知:X有两种氧化物M和N。Y与Se是相邻周期同主族元素,其中Se可以从电解精炼铜的阳极泥中获得。从阳极泥中提取Se的流程如下:
回答下列问题:(各元素用相应的元素符号表示)
(1)写出X和Y形成的化合物的电子式 。
(2)阳极泥中Se以单质、Ag2Se、Cu2Se等形式存在。写出①中Se单质与浓硫酸反应的化学方程式 。
(3)写出反应②的化学方程式为 。
(4)某温度下在容积固定的密闭容器中,下列反应达到平衡:M(g)+H2O(g) N(g)+H2(g)
N(g)+H2(g)
| n(M):n(H2O) | M转化率 | H2O转化率 |
| 1:1 | 0.5 | 0.5 |
| 1:2 | 0.67 | 0.335 |
| 1:3 | 0.75 | 0.25 |
写出上述反应的热化学方程式 。
②该反应的平衡常数为 。该温度下,向容器中充入1molM、3mol H2O、2mol N、1.5molH2,则起始时该反应速率V正 V逆(填“>”、“<”或“=”)
③结合表中数据判断下列说法中正确的是
| A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低 |
| B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同 |
| C.M和H2O(g)初始物质的量之比等于二者转化率之比 |
| D.当M与H2O(g)物质的之比为1:4时,M的转化率为0.85 |

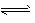 N(g)+H2(g)
N(g)+H2(g) 