题目内容
物质结构的多样性让人类使用的材料精彩纷呈。
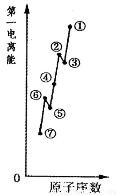
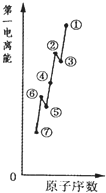
(1)如图是原子序数相连的七种短周期元素第一电离能示意图。其中硼B元素是???????? (填图中元素代号)。
(2)乙二酸俗名草酸,是最简单的有机二元酸之一,结构简式为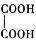 ,草酸钠晶体中存在???????? (填图中元素代号)。
,草酸钠晶体中存在???????? (填图中元素代号)。
A金属键;B非极性键;C键;D范德华力;E氢键;F离子键
(3)氧化锆(ZrO2)材料具有高硬度,高强度,高韧性,极高的耐磨性及耐化学腐蚀性,氧化锆陶瓷在许多领域获得广泛应用。锆石与钛同族的第五周期元素,锆原子的价电子排布式为????????? 。
(4)含氧酸可电离的氢原子来自羟基,碳酸的结构式可表达为???????? ;若碳酸中的碳氧原子都在同一平面,则碳原子的杂化类型是???????????? 。
(5)PtCl4和氨水反应可获得PtCl4? 4NH3,PtCl4?4NH3 是一种配合物。100mL0.1mol?L-1PtCl4?4NH3 溶液中滴加足量AgNO3溶液可产生2.87g白色沉淀。该配合物溶于水的电离方程式为???????????????????????????? 。
(1)⑤(2分)
(2)BCF(2分)
(3)4d25s2? (2分)
(4)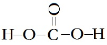 (2分)????? ??? sp2(2分)
(2分)????? ??? sp2(2分)
(5)〔PtCl2(NH3)4〕Cl2 = 〔PtCl2(NH3)4〕2+ + 2Cl- (3分)
【解析】
试题分析:(1)同周期元素的第一电离能从左到右依次增大趋势,但第ⅡA、ⅤA族元素的原子最外层电子呈全满和半满的相对稳定结构,能量较低,第一电离能较大,故②、⑥分别为Be、N,⑤为B元素;(2)草酸钠为离子晶体,含有离子键、草酸根离子中含有非极性键(碳碳键)、极性键(碳氢键、碳氧键);(3)同族元素原子价电子排布相同;(4)根据题意含有2个羟基,还应含有羰基,故结构式为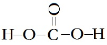 ;分子空间结构为平面结构故碳原子为sp2;
;分子空间结构为平面结构故碳原子为sp2;
(5)n(Cl-)= n(AgCl)=2.87÷143.5=0.02mol
???? n(PtCl4?4NH3)= 0.1×0.1=0.01mol,所以1mol能电离出2个氯离子,即外界有2个氯离子,化学式为PtCl2(NH3)4〕Cl2,电离方程式为〔PtCl2(NH3)4〕Cl2 = 〔PtCl2(NH3)4〕2+ + 2Cl-。
考点:考查物质结构与性质有关问题。

(1)C、Si、N三种元素的电负性由大到小的顺序为
(2)2010年诺贝尔物理学奖所指向的是碳的又一张奇妙面孔;人类已知的最薄材料--石墨烯.
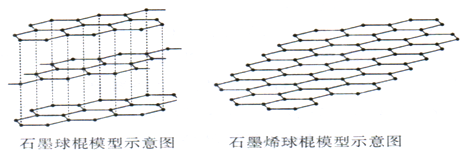
①下列说法中,正确的是
A.碳各种单质的晶体类型相同 B.石墨烯含有非极性键
C.从石墨剥离得到石墨烯需要破坏化学键 D.石墨烯具有导电性
②石墨烯中,每个碳原子通过
③化学气相沉积法是获得石墨烯的有效方法之一,催化剂可以用金、铜等金属.根据下表数据,铜的第一电离能 (I1) 小于锌的第一电离能,试解释铜的第二电离能(I2)却大于锌的第二电离能的主要原因
| 电离能/KJ?mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
| 化学键 | C-O | C=O | C≡O |
| 键能/KJ?mol-1 | 351 | 803 | 1071 |
| 化学键 | N-N | N=N | N≡N |
| 键能/KJ?mol-1 | 159 | 418 | 946 |
 物质结构的多样性让人类使用的材料精彩纷呈.
物质结构的多样性让人类使用的材料精彩纷呈.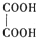 ,草酸钠晶体中存在
,草酸钠晶体中存在