题目内容
5.甲、乙两瓶氨水的浓度分别为1mol•L-1、0.1mol•L-1,则两瓶氨水中c(OH)-之比( )| A. | 等于10 | B. | 小于10 | C. | 大于10 | D. | 等于1 |
分析 一水合氨为弱电解质,浓度越大,电离程度越小,以此解答该题.
解答 解:甲、乙两瓶氨水的浓度分别为1摩/升和0.1摩/升,则甲瓶氨水的浓度是乙瓶氨水的浓度的10倍,又弱电解质的浓度越小,电离程度越大,故甲瓶氨水的电离度比乙瓶氨水的电离度小,所以甲、乙两瓶氨水中[OH-]之比小于10.
故选B.
点评 本题考查学生弱电解质的电离平衡的影响因素以及电离平衡的应用知识,为高频考点,侧重考查学生的分析能力,注意把握弱电解质的电离特点,难度不大.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
3.某学生的实验报告所列出的下列数据中合理的是( )
| A. | 用10mL量筒量取7.13mL稀盐酸 | |
| B. | 用pH试纸测得某稀盐酸的pH为1.5 | |
| C. | 用碱式滴定管量取20.3 mL烧碱溶液 | |
| D. | 用托盘天平称得某物质的质量为13.1g |
16.下列溶液中有关物质的浓度关系正确的是( )
| A. | c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c>c(NH4Cl) | |
| B. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 等物质的量的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) | |
| D. | 某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-) |
13.下列有机物中不能发生银镜反应的是( )
| A. | 麦芽糖 | B. | 乙酸 | C. | 甲酸甲酯 | D. | 乙醛 |
20.下列物质分子中的所有原子不可能处于同一平面的是( )
| A. | 苯 | B. | 乙烯 | C. | 水 | D. | 甲烷 |
10.用石油和煤可以得到有机化工生产中需要的众多原料,例如由石油得到的乙烯和由煤得到的苯制聚苯乙烯.生产过程如下:
①CH2═CH2+ →
→
② $\stackrel{-H_{2}}{→}$
$\stackrel{-H_{2}}{→}$ 
③ →
→
下列说法不正确的是( )
①CH2═CH2+
 →
→
②
 $\stackrel{-H_{2}}{→}$
$\stackrel{-H_{2}}{→}$ 
③
 →
→
下列说法不正确的是( )
| A. | 通过裂解可以从石油中获得更多的乙烯 | |
| B. | 把煤干馏可以得到粗苯,经分馏可以得到苯 | |
| C. | 制聚苯乙烯的反应①为取代反应,②为消去反应③为加聚反应 | |
| D. | 反应①②③的原子利用率不都为100% |
17.短周期元素 W、X、Y 和 Z 在周期表中的相对位置如表所示,这四种元素原子的最外电子数之和为21.下列关系正确的是( )
| W | X | |||
| Y | Z |
| A. | 氢化物沸点:W<Z | |
| B. | 氧化物对应水化物的酸性:Y>W | |
| C. | 简单离子的半径:Y<X | |
| D. | 用电解熔融态 YZ3 的方法制取来单质 Y |
14.化学与生活密切相关,下列说法错误的是( )
| A. | 将燃油车改为燃气车有利于减少污染物排放 | |
| B. | 含氟牙膏能有效预防龋齿,且其中所加氟化物的量宜多不宜少 | |
| C. | 糖类、油脂及蛋白质都含有C、H、O元素 | |
| D. | 酸雨浸蚀的土壤中加入熟石灰,可对该土壤进行修复 |

 ,名称是环己烷.
,名称是环己烷.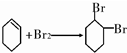 .
.