题目内容
Fe元素是地壳中最丰富的元素之一,在金属中含量仅次于铝,铁及其化合物在生活生产中有广泛应用。请回答下列问题。
(1)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4+4CO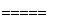 3Fe+4CO2,若有1 mol Fe3O4参加反应,转移电子的物质的量是________ mol。
3Fe+4CO2,若有1 mol Fe3O4参加反应,转移电子的物质的量是________ mol。
(2)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是___________________________________________________。
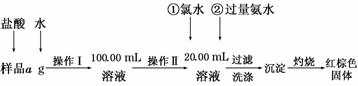
(3)某课外活动小组将下图所示装置按一定顺序连接,在 实验室里制取一定量的FeCl3(所通气体过量并充分反应)。
实验室里制取一定量的FeCl3(所通气体过量并充分反应)。
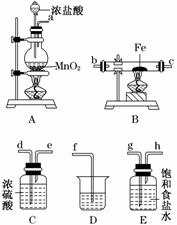
请回答下列问题:
①各装置的正确连接顺序为(填写装置代号)
A→________→________→________→D。
②装置C的作用是_______________________________________________________。
③反应开始后,B中硬质玻璃管内的现象为________;可以检验生成物中含有Fe3+的试剂是________(填写试剂名称)。
解析:(1)1 mol Fe3O4参加反应消耗4 mol CO, 1 mol CO转变为CO2失去2 mol电子,故转移电子的物质的量是8 mol。(2)Fe3+的水解受到H+的抑制作用,故得不到Fe(OH)3胶体。(3)根据2Fe+3Cl2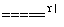 2FeCl3可知,要考虑到氯气的纯度、Fe3+的水解等因素,需要对氯气除杂,尾气需要处理。
2FeCl3可知,要考虑到氯气的纯度、Fe3+的水解等因素,需要对氯气除杂,尾气需要处理。
答案:(1)8 (2)因酸性废液中,H+将会抑制Fe3+的水解,无法得到Fe(OH)3胶体,故不能够吸附悬浮物 (3)①E C B ②干燥Cl2,防止FeCl3的水解而产生Fe2O3杂质 ③产生棕(红)色的烟 硫氰化钾

下列混合物的除杂方法与发生反应的类型均正确的是
| 混合物 | 加入试剂或方法 | 反应类型 | |
| A | 除去O2中的CO | 通入炽热的CuO中 | 化合反应 |
| B | 除去CO2中的HCl | 通入饱和NaHCO3溶液中 | 中和反应 |
| C | 除去CaCO3中的Na2CO3 | 溶解、加入BaCl2溶液 | 复分解反应 |
| D | 除去NaCl中的Na2CO3 | 加入适量盐酸、蒸发 | 复分解反应 |
下列化学实验事实及其结论都正确的是( )
| 选项 | 实验事实 | 结论 |
| A | 将SO2通入含HClO的溶液中生成H2SO4 | HClO的酸性比H2SO4强 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| C | SiO2可以和NaOH溶液及HF溶液反应 | SiO2属于两性氧化物 |
| D | 将SO2通入溴水中,溴水褪色 | SO2具有还原性 |
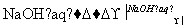 NaAlO2(aq)
NaAlO2(aq)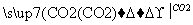 Al(OH)3
Al(OH)3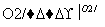 SO3
SO3 H2SO4
H2SO4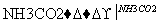 NaHCO3
NaHCO3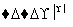 Na2CO3
Na2CO3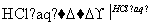 FeCl3(aq)
FeCl3(aq) D.
D.
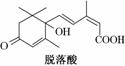
 ,脱落酸(如图)可用作植物生长抑制剂,下列对该物质的叙述正确的是( )
,脱落酸(如图)可用作植物生长抑制剂,下列对该物质的叙述正确的是( )