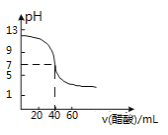
题目内容
【题目】常温下,现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题:
(1)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为: pH(甲)___________pH(乙)(填“大于”、“小于”或“等于”)。
(2)各取25mL的甲、乙两溶液,分别用等浓度的 NaOH 稀溶液中和至 pH=7,则消耗的 NaOH 溶 液的体积大小关系为:V(甲)_____________V(乙)(填“大于”、“小于”或“等于”)。
(3)pH=2的醋酸溶液中由水电离出的c(H+)________0.01mol/LHCl溶液中由水电离出的c(H+)。(填“>”、“<”、或“=”)
【答案】小于 大于 =
【解析】
(1)氯化氢是强电解质,完全电离,醋酸是弱电解质,溶液中存在电离平衡,加水稀释促进醋酸电离,所以醋酸溶液中氢离子浓度减小程度小于盐酸溶液中氢离子浓度减小的程度,所以醋酸的pH小于盐酸,故答案为:小于。
(2)各取体积相等的两溶液,醋酸的物质的量较大,经NaOH稀溶液中和至相同pH时,消耗NaOH溶液的体积V(甲)>V(乙),故答案为:大于。
(3)pH=2的醋酸中c(H+)=0.01molL-1,c(H+)水=c(OH-)水=![]() =
=![]() =10-12mol/L;0.01molL-1的盐酸中c(H+)=0.01molL-1,c(H+)水=c(OH-)水=
=10-12mol/L;0.01molL-1的盐酸中c(H+)=0.01molL-1,c(H+)水=c(OH-)水=![]() =
=![]() =10-12mol/L;所以pH=2的醋酸溶液中由水电离出的c(H+)与0.01mol/LHCl溶液中由水电离出的c(H+)相等,故答案为:=。
=10-12mol/L;所以pH=2的醋酸溶液中由水电离出的c(H+)与0.01mol/LHCl溶液中由水电离出的c(H+)相等,故答案为:=。

练习册系列答案
相关题目