题目内容
已知33As、35Br位于同一周期。某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是 。已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式是 。
(2)在该反应条件下可推知 (填序号)。
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X d.还原性:X>AsH3
(3)该反应的氧化剂和还原剂的物质的量之比为__________; KBrO3与HBr反应也会生成X,则该反应中氧化剂和还原剂的物质的量之比为__________。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是 。已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式是 。
(2)在该反应条件下可推知 (填序号)。
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X d.还原性:X>AsH3
(3)该反应的氧化剂和还原剂的物质的量之比为__________; KBrO3与HBr反应也会生成X,则该反应中氧化剂和还原剂的物质的量之比为__________。
(1)AsH3 Br2 (2分)(2)a c(2分) (3)8 : 5(2分) ,1:5(2分)
试题分析:(1)AsH3中As元素化合价升高生成H3AsO4,所以AsH3为还原剂;0.2mol KBrO3在反应中得到1mol电子生成X,1个Br原子得5个电子,X中Br的化合价为0,故X为Br2。
(2)在同一氧化还原反应中,氧化剂的氧化性大于氧化产物,还原剂的还原性大于还原产物,故a、c正确。
(3)根据氧化剂所得电子总数与还原剂失去电子总数相等,5×n(KBrO3)=8×n(AsH3),得n(KBrO3): n(AsH3)=" 8" : 5;5×n(KBrO3) =1×n(HBr),得n(KBrO3):(HBr)=1:5。

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案
相关题目
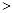 NaNO2 B.氧化性:NaNO2
NaNO2 B.氧化性:NaNO2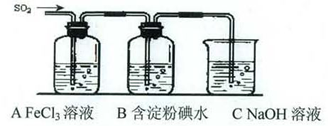
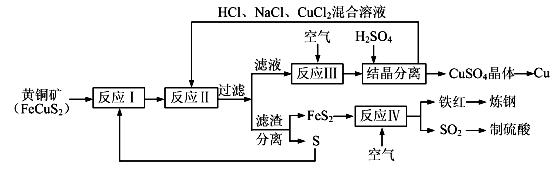
 8Cu+4FeO+2Fe2O3+16SO2,下列有关该反应的说法正确的是 ___________________ (填字母)。
8Cu+4FeO+2Fe2O3+16SO2,下列有关该反应的说法正确的是 ___________________ (填字母)。