题目内容
(13分)下表为元素周期表的一部分,请参照元素①—⑩在表中的位置,
回答下列问题:
(1) ⑩的离子结构示意图为 。
(2)④⑤⑥⑨⑩的离子半径由大到小的顺序为______________(用离子符号表示)。
(3)④的氢化物沸点比⑨高,说明理由____________________________。
(4)上述元素构成的两个不同的10电子微粒,能反应生成两个相同的10电子微粒。写出二者反应的方程式为________ ________。
(5)由④⑤两种元素组成的一种化合物加入到硫酸亚铁溶液中,立即产生红褐色沉淀,但无气体产生,该化合物的电子式 ,该反应的离子方程式___ ___。
回答下列问题:
 族 族周期 | IA | | | | | | | 0 |
| 1 | ① | ⅡA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | | ⑨ | ⑩ | |
(2)④⑤⑥⑨⑩的离子半径由大到小的顺序为______________(用离子符号表示)。
(3)④的氢化物沸点比⑨高,说明理由____________________________。
(4)上述元素构成的两个不同的10电子微粒,能反应生成两个相同的10电子微粒。写出二者反应的方程式为________ ________。
(5)由④⑤两种元素组成的一种化合物加入到硫酸亚铁溶液中,立即产生红褐色沉淀,但无气体产生,该化合物的电子式 ,该反应的离子方程式___ ___。
(13分)(1) 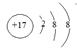 2分 (2)S2->Cl->Na+>Mg2+ 2分
2分 (2)S2->Cl->Na+>Mg2+ 2分
(3)原因是液态水分子间存在氢键2分 (4)H3O++OH-=2H2O 2分
(5)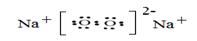 2分
2分
3Na2O2+6Fe2++6H2O=6Na++4Fe(OH)3↓+2Fe3+ 3分
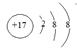 2分 (2)S2->Cl->Na+>Mg2+ 2分
2分 (2)S2->Cl->Na+>Mg2+ 2分(3)原因是液态水分子间存在氢键2分 (4)H3O++OH-=2H2O 2分
(5)
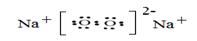 2分
2分3Na2O2+6Fe2++6H2O=6Na++4Fe(OH)3↓+2Fe3+ 3分
略

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 。
。 子方程式_______________________________,______________________。
子方程式_______________________________,______________________。 电
电 子数之和的三倍,Y、Z左右相邻,Z、W位于同一主族。
子数之和的三倍,Y、Z左右相邻,Z、W位于同一主族。
 常用做为示踪原子
常用做为示踪原子
 下列问题:
下列问题: 的是
的是  (填化学式),沸点最高的是 (填化学式)。
(填化学式),沸点最高的是 (填化学式)。